
Nueva estrategia para proteger a los linfocitos de la infección por HIV
Para que el HIV-1 entre en los glóbulos blancos, debe unirse a la proteína CD4 y a los correceptores CXCR4 o CCR5. Las cepas X4 del HIV-1 usan el correceptor CXCR4, mientras que las cepas R5 utilizan el CCR5. En personas recién infectadas por el virus del sida se aísla principalmente la cepa R5 del HIV-1, la cual infecta a células del sistema inmune tales como macrófagos, células dendríticas y linfocitos T CD4+. Estas células, que expresan CCR5 y algo de CXCR4, se encuentran en la mucosa genital y rectal y en los órganos linfoides del aparato digestivo. En la mitad de los pacientes, las cepas R5 mutan a cepas X4, un cambio que se asocia a la pérdida de linfocitos T CD4+ y al desarrollo de la enfermedad.
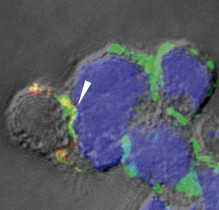 En un estudio que investigadores del Centro Nacional de Biotecnología del CSIC (CNB) publican en la revista Proceedings of the National Academy of Sciences USA se determina que CD4, CXCR4 y CCR5 forman oligómeros en las membranas de las células. Los resultados muestran además que la proporción de CXCR4 respecto a CCR5 controla la unión a las membranas de las cepas X4 del HIV-1, un paso necesario para que se produzca la entrada del HIV a las células hospedadoras. Los autores de este trabajo concluyen que según sean los niveles de CCR5 en las células diana, la unión de los virus X4 HIV-1 y por lo tanto su entrada en las células y la infección resultan bloqueadas. Este descubrimiento podría aplicarse para proteger a los linfocitos de la infección por HIV.
En un estudio que investigadores del Centro Nacional de Biotecnología del CSIC (CNB) publican en la revista Proceedings of the National Academy of Sciences USA se determina que CD4, CXCR4 y CCR5 forman oligómeros en las membranas de las células. Los resultados muestran además que la proporción de CXCR4 respecto a CCR5 controla la unión a las membranas de las cepas X4 del HIV-1, un paso necesario para que se produzca la entrada del HIV a las células hospedadoras. Los autores de este trabajo concluyen que según sean los niveles de CCR5 en las células diana, la unión de los virus X4 HIV-1 y por lo tanto su entrada en las células y la infección resultan bloqueadas. Este descubrimiento podría aplicarse para proteger a los linfocitos de la infección por HIV.
Sin la existencia en la actualidad de una vacuna efectiva contra el sida, “una nueva estrategia para impedir la infección del sida podría ser el diseño de fármacos que mimetizaran los efectos de CCR5 en las membranas celulares”, explica Mario Mellado, científico del CNB e investigador principal de este estudio. Comenta además que estos resultados ayudan a comprender por qué las cepas X4 del HIV-1 “conducen a una progresión más rápida de la enfermedad con un empeoramiento de los síntomas” y cómo la proporción de los receptores influye en la susceptibilidad a la infección.
- • Martínez-Muñoz L, Barroso R, Dyrhaug SY, Navarro G, Lucas P, Soriano SF, Vega, B, Costas C, Muñoz-Fernández MA, Santiago C, Rodríguez-Frade JM, Franco R, Mellado M. CCR5/CD4/CXCR4 oligomerization prevents HIV-1 gp120IIIB binding to the cell surface. Proc Natl Acad Sci USA. 2014; doi: 10.1073/pnas.1322887111.
2nd CNB Course on Introduction to Research
The Centro Nacional de Biotecnología (CNB-CSIC) is organising its 2nd Course on Introduction to Research for students in the final years of any university degree in science. The course is designed for qualified, highly motivated students who would like to contact the scientists at the CNB. The goal of this course is to provide an overview of the centre’s cutting-edge research facilities.
 The four-week course will be held from June 30 to July 25, 2014. Up to 12 selected students will be registered free of charge.
The four-week course will be held from June 30 to July 25, 2014. Up to 12 selected students will be registered free of charge.
For four weeks, the students will participate in the scientific activities of two research departments of their choice (2 weeks each), attend seminars on hot topics in today’s life sciences, and meet and talk with CNB scientists. Candidates are counselled to visit our website to learn about our projects and interests.
The completed application (doc/odt/pdf) form must be received before 30 May 2014, by e-mail to Alfonso Mora or by post to the Centro Nacional de Biotecnología (2nd Course on Introduction to Research), c/ Darwin #3, 28049 Madrid, Spain.
SELECTED STUDENTS
- Ricardo Sánchez de la Nieta Moreno
- Sara Herrera de la Mata
- Alberto Jesús González Hernández
- Andrés Sanz Morejón
- Iris Barragán Sánchez
- Dorota Kuczek
- Sergio Gómez López
- Isabel Tundidor Pérez
- Adolfo Alsina López
- Lorena Blázquez Conchillo
- Pilar Montero Calle
- Julio Téllez de Pablos
Cómo los potyvirus infectan las plantas sin matarlas
A lo largo de su evolución, los virus ARN han incorporado una serie de mecanismos para solventar las limitaciones de tener un genoma pequeño y relativamente sencillo. Deben asegurar que dentro de la célula hospedadora esté disponible tanto en el espacio como en el tiempo todo aquello necesario para su replicación, ensamblaje y amplificación. En este tipo de virus, una de las estrategias más comunes para disponer en un momento preciso de las proteínas necesarias es la proteolisis de una poliproteína.
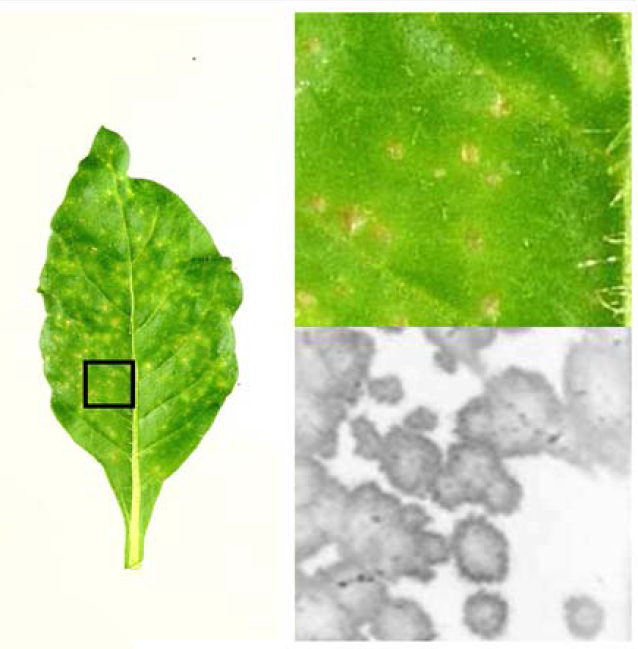 El grupo de investigación de Juan Antonio García y Carmen Simón centra sus esfuerzos en el Centro Nacional de Biotecnología del CSIC (CNB) en la endopeptidasa P1 de uno de los principales grupos de virus ARN que infectan a las plantas, los potyvirus. Aunque no se sabía su contribución exacta a la infección viral, algunos datos indicaban que P1 estaba implicada en la selección de hospedadores por parte del virus. Ahora, este grupo acaba de mostrar que el extremo amino-terminal de la proteína P1 de los potyvirus reduce la actividad autoproteolítica de esta enzima según el hospedador en el que se encuentre. Fabio Pasin, que realiza sus tesis doctoral en el CNB gracias a una beca de la Fundación La Caixa, ha observado que al eliminar esta región de la proteína P1 se acelera la replicación temprana del virus y aumenta la severidad de los síntomas. Todo ello, acompañado en la planta de un mayor número de marcadores marcadores de resitencia y una menor acumulación de virus.
El grupo de investigación de Juan Antonio García y Carmen Simón centra sus esfuerzos en el Centro Nacional de Biotecnología del CSIC (CNB) en la endopeptidasa P1 de uno de los principales grupos de virus ARN que infectan a las plantas, los potyvirus. Aunque no se sabía su contribución exacta a la infección viral, algunos datos indicaban que P1 estaba implicada en la selección de hospedadores por parte del virus. Ahora, este grupo acaba de mostrar que el extremo amino-terminal de la proteína P1 de los potyvirus reduce la actividad autoproteolítica de esta enzima según el hospedador en el que se encuentre. Fabio Pasin, que realiza sus tesis doctoral en el CNB gracias a una beca de la Fundación La Caixa, ha observado que al eliminar esta región de la proteína P1 se acelera la replicación temprana del virus y aumenta la severidad de los síntomas. Todo ello, acompañado en la planta de un mayor número de marcadores marcadores de resitencia y una menor acumulación de virus.
Estos resultados sugieren que el ajuste fino de la actividad de la proteasa P1 ha evolucionado para mantener la amplificación del virus a unos niveles no que causen demasiado daño al hospedador asegurando, eso si, la óptima replicación a largo plazo del virus. El estudio, que acaba de publicarse en la revista PLOS Pathogens, aporta nuevos datos experimentales que apoyan la teoría de que los virus mantienen unos niveles de replicación adecuados en dos hospedadores diferentes.
- Pasin F, Simón-Mateo C, García JA. The hypervariable amino-terminus of P1 protease modulates potyviral replication and host defense responses. PLoS Pathog. 2014; 10(3): e1003985.
Una pequeña proteína que regula el estrés hídrico
Las células eucariotas cuentan con el llamado sistema ubiquitino-proteosómico para degradar sus proteínas. Pero no es solo un sistema de deshecho, si no que al actuar de forma selectiva sobre algunas de ellas, es un mecanismo de control de la homesotasis de las proteínas, algo esencial en procesos vitales de las plantas como puedan ser la embriogénesis o la floración.
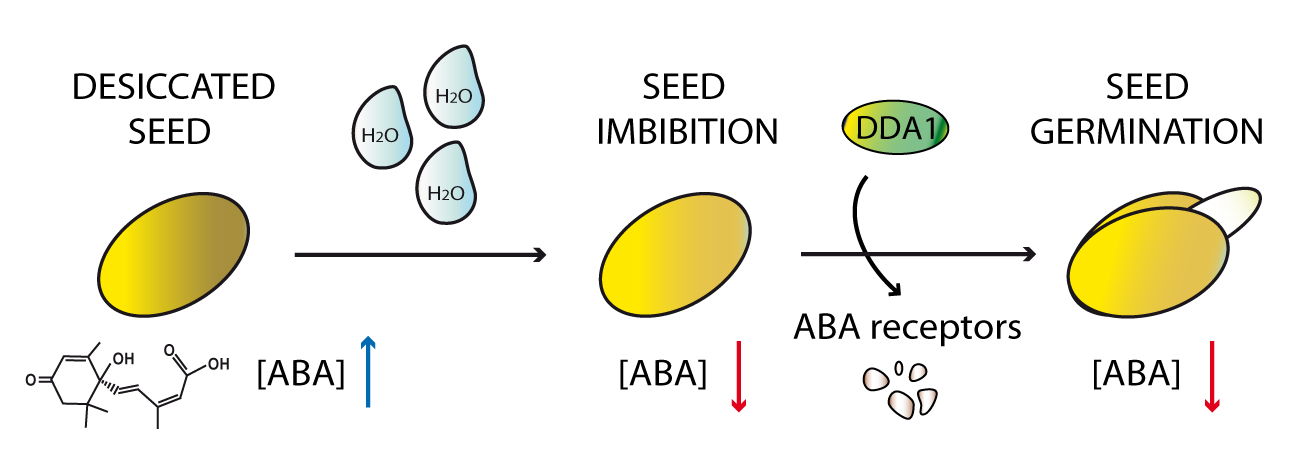
 En su laboratorio del Centro Nacional de Biotecnología del CSIC (CNB), el grupo de Vicente Rubio estudia cómo el sistema ubiquitino-proteosómico regula el crecimiento de las plantas cuando están sometidas a estreses ambientales. Y acaban de descubrir en Arabidopsis que la pequeña proteína DDA1, existente tanto en plantas como en animales, es esencial para la estabilidad de los receptores de la hormona ácido abscísico (ABA). Esta hormona vegetal participa en la germinación de las semillas, controla el desarrollo de las plántulas e inicia las respuestas ante los estreses ambientales. Conocido como la "hormona de la sequía", el ácido abscísico es fundamental para que las plantas se adapten a la salinidad y al estrés osmótico, permitiéndolas vivir en condiciones adversas.
En su laboratorio del Centro Nacional de Biotecnología del CSIC (CNB), el grupo de Vicente Rubio estudia cómo el sistema ubiquitino-proteosómico regula el crecimiento de las plantas cuando están sometidas a estreses ambientales. Y acaban de descubrir en Arabidopsis que la pequeña proteína DDA1, existente tanto en plantas como en animales, es esencial para la estabilidad de los receptores de la hormona ácido abscísico (ABA). Esta hormona vegetal participa en la germinación de las semillas, controla el desarrollo de las plántulas e inicia las respuestas ante los estreses ambientales. Conocido como la "hormona de la sequía", el ácido abscísico es fundamental para que las plantas se adapten a la salinidad y al estrés osmótico, permitiéndolas vivir en condiciones adversas.
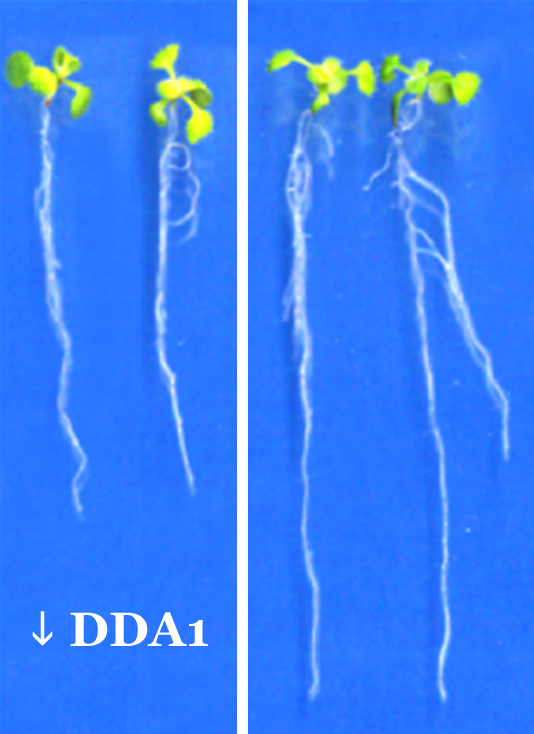
En su último trabajo, que acaban de publicar en la revista Plant Cell, María Luisa Irigoyen y Elisa Iniesto, junto a otros miembrops del grupo de Rubio, demuestran en la planta Arabidopsis thaliana que DDA1 forma parte de un complejo de proteínas implicado en la degradación proteosomal. Han encontrado que en las semillas y en las plántulas, esta pequeña proteínas se una alos recpetores del ácido abscísico facilitando así su degradación. De este modo, explica Rubio, tiene una función "negativa en la regulación de las respuestas a los estreses abióticos medidadas por ABA".
Los niveles de ABA son elevados en las semillas secas, lo que impide sus germinación. En las plantas adultas, estos niveles elevados lo que hacen es inhibir el crecimiento de las raíces y promover en las hojas el cierre de los estomas por los que la planta intercambia los gases. Cuando las condiciones ambientales son óptimas, los niveles de ABA disminuyen, los complejos que contiene DDA1 se activan más, degradando los receptores de ABA. Esto último consigue mantener los niveles necesarios de ABA a la vez que minimiza sus efectos inhibitorios (cierre de los estomas y retraso del crecimeinto) justo en el momento que no es necesario, durante la germinación o cuando no hay estrés.
- Irigoyen ML, Iniesto E, Rodríguez L, Puga MI, Yanagawa Y, Pick E, Strickland E, Paz-Ares J, Wei N, De Jaeger G, Rodriguez PL, Deng XW, Rubio V. Targeted degradation of abscisic acid receptors is mediated by the ubiquitin ligase substrate adaptor DDA1 in Arabidopsis. Plant Cell. 2014; doi: 10.1105/tpc.113.122234.
Descubren un mecanismo que regula el tamaño de los cilios
En la superficie de muchos tipos de células los mamíferos podemos encontrar cilios, los cuales participan en multitud de procesos fisiológicos que van desde el crecimiento celular y el desarrollo hasta la percepción del ambiente en el que se encuentran. Su importancia se pone de manifiesto si tenemos en cuenta algunas enfermedades causadas por defectos en estos orgánulos: el hidrocéfalo, la anosmia (pérdida del olfato) o la retinitis pigmentaria.
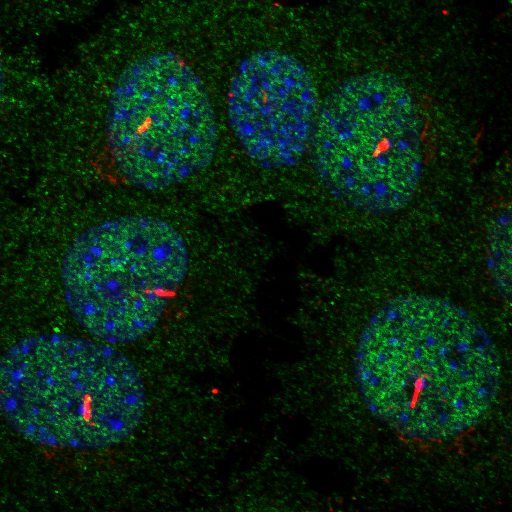 El grupo de investigación del Centro Nacional de Biotecnología del CSIC dirigido por Karel H.M. van Wely estudia las proteínas involucradas en la formación y en el desensamblaje de los cilios. Si bien se conoce desde hace tiempo su regulación asociada a la mitosis de la céllulas, en este laboratorio del CNB se acaban de encontrar un mecanismo que regula el tamaño de los cilios cuando la célula no se está dividiendo. Los experimentos que ha realizado en este laboratorio Ainhoa Sánchez de Diego, y que acaba de publicar en la revista Nature Communications, muestran que cuando las céllulas no están creciendo la distribución subcelular de la deacetilasa HDAC6 es esencial para controlar el tamaño de los cilios.
El grupo de investigación del Centro Nacional de Biotecnología del CSIC dirigido por Karel H.M. van Wely estudia las proteínas involucradas en la formación y en el desensamblaje de los cilios. Si bien se conoce desde hace tiempo su regulación asociada a la mitosis de la céllulas, en este laboratorio del CNB se acaban de encontrar un mecanismo que regula el tamaño de los cilios cuando la célula no se está dividiendo. Los experimentos que ha realizado en este laboratorio Ainhoa Sánchez de Diego, y que acaba de publicar en la revista Nature Communications, muestran que cuando las céllulas no están creciendo la distribución subcelular de la deacetilasa HDAC6 es esencial para controlar el tamaño de los cilios.
En esta publicación se demuestra que no sólo es necesario que una quinasa active a HDAC6, es también clave para actuar sobre un sustrato u otro la localización de la deacetilasas en el interior de la célula. La proteína Dido3, descubierta por este mismo grupo, es fundametal a la hora de regular tanto los niveles de HDCA6 en la base de los cilios como el grado de acetilación de la tubulina.
- Sánchez de Diego A, Guerrero AA, Martínez-A C, van Wely KHM. Dido3-dependent HDAC6 targeting controls cilium size. Nat Commun. 2014; doi: 10.1038/ncomms4500.
Nuevo papel de las p38 MAP quinasas en la artritis reumatoide
La artritis reumatoide es una enfermedad autoinmune que aunque afecta principalmente a las articulaciones, causa también inflamación crónica en multitud de tejidos y órganos. Se calcula que afecta al 1% de la población, con síntomas desde la hiperplasia sinovial hasta la destrucción de las articulaciones. Todos estos síntomas son consecuencia de una liberación continua y desregulada de citoquinas inflamatorias.
 El grupo de Ana Cuenda investiga en el Centro Nacional de Biotecnología del CSIC (CNB) el papel que juegan en la regulación de la producción de citoquinas las cuatro quinasas de la familia p38MAPK. En concreto, centran sus esfuerzos en ver la implicación específica de cada una de ellas en la patogénesis de la artritis reumatoide con la intención de que se puedan desarrollar nuevos tratamientos más eficaces y seguros que los actuales.
El grupo de Ana Cuenda investiga en el Centro Nacional de Biotecnología del CSIC (CNB) el papel que juegan en la regulación de la producción de citoquinas las cuatro quinasas de la familia p38MAPK. En concreto, centran sus esfuerzos en ver la implicación específica de cada una de ellas en la patogénesis de la artritis reumatoide con la intención de que se puedan desarrollar nuevos tratamientos más eficaces y seguros que los actuales.
En un trabajo que acaban de publicar en colaboración con investigadores del Hospital '12 de Octubre' de Madrid en la revista Arthritis and Rheumatism, el grupo de Cuenda presenta el descubrimiento de que la eliminación de los genes de las quinasas p38γ y p38δ “reduce significativamente tanto la incidencia como la severidad de la artritis“. Induciendo artritis en ratones con colágeno, la falta de estas dos proteínas se acompañaba además con una menor producción de citoquinas. Estos resultados, comenta Cuenda, muestran que las quinasas p38γ y p38δ son cruciales para regular la inflamación de las articulaciones y la destrucción de los huesos que se producen en la artrtitis y, por tanto, serían dos nuevas dianas terapéuticas en el tratamiento de la artritis reumatoide.
- Criado G, Risco A, Alsina-Beauchamp D, Pérez-Lorenzo MJ, Escós A, Cuenda A. Alternative p38 mitogen-activated protein kinases are essential for collagen-induced arthritis. Arthritis Rheum. doi: 10.1002/art.38327.
Nueva generación de la base de datos de proteínas del centrosoma
El gobierno de la Comunidad de Madrid recientemente financió el proyecto de investigación PROFUN II: Interactomics of the Centrosome (CS Interactomics) que tiene como objetivo el estudio de la interactómica del centrosoma, un orgánulo celular clave en el proceso de organización de la arquitectura celular. En este proyecto, varios grupos de investigadores de Madrid están uniendo esfuerzos para proporcionar un impulso cualitativo al conocimientos del centrosoma, una pieza fundamental para la comprensión de la célula.
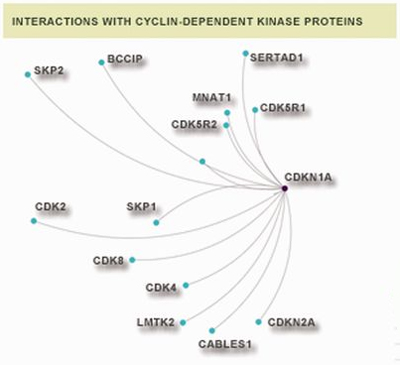 En este contexto, el grupo de Bioinformática funcional del CNB dirigido por Alberto Pascual-Montano ha desarrollado CentrosomeDB, una base de datos que recoge e integra información relevante sobre el centrosoma. Esta base de datos ofrece diferentes perspectivas para el estudio de las proteínas del centrosoma, incluyendo su estructura, su función y su evolución. Además, contiene información sobre las homologías con las proteínas de otras especies, así como datos de su función, su relación con enfermedades (SNP) o la estructura tridimensional de las mismas. Se han incorporado también, resultados sobre las interacciones demostradas entre las proteínas.
En este contexto, el grupo de Bioinformática funcional del CNB dirigido por Alberto Pascual-Montano ha desarrollado CentrosomeDB, una base de datos que recoge e integra información relevante sobre el centrosoma. Esta base de datos ofrece diferentes perspectivas para el estudio de las proteínas del centrosoma, incluyendo su estructura, su función y su evolución. Además, contiene información sobre las homologías con las proteínas de otras especies, así como datos de su función, su relación con enfermedades (SNP) o la estructura tridimensional de las mismas. Se han incorporado también, resultados sobre las interacciones demostradas entre las proteínas.
Desde su publicación, esta nueva jerramienta ha recibido ya más de 10.000 visitas al ser probablemente la base de datos más completa de proteínas del centrosoma. En estos momentos contiene 1.053 proteínas centrosomales humanas y 304 de Drosophila melanogaster, una mejora significativa respecto a otras herramientas y repositorios existentes.
La base de datos se puede consultar públicamente en http://centrosome.cnb.csic.es.
- Alves-Cruzeiro JM, Nogales-Cadenas R, Pascual-Montano AD. CentrosomeDB: a new generation of the centrosomal proteins database for Human and Drosophila melanogaster. Nucleic Acids Res. 2014; 42(1): D430-D436.
El CNB recibe la acreditación ‘Severo Ochoa’
El Centro Nacional de Biotecnología del CSIC (CNB) ha sido distinguido por un jurado internacional en el marco del programa de excelencia Severo Ochoa. La acreditación como centro de excelencia Severo Ochoa tiene una validez de cuatro años y proporciona un millón de euros anuales para el CNB.
 Este reconocimiento, que llega en un momento de dificultades por la actual situación económica del país, es sobre todo, como explica la directora del CNB Carmen Castresana “un reconocimiento al trabajo y al esfuerzo de todos los que trabajamos y hemos trabajado en el CNB”.
Este reconocimiento, que llega en un momento de dificultades por la actual situación económica del país, es sobre todo, como explica la directora del CNB Carmen Castresana “un reconocimiento al trabajo y al esfuerzo de todos los que trabajamos y hemos trabajado en el CNB”.
La financiación Ochoa nos permitirá emprender acciones estratégicas que beneficien al centro en su conjunto. En concreto, en el Centro Nacional de Biotecnología, dedicaremos la financiación obtenida a implementar nuevas aproximaciones científicas basadas en programas de Biología de Sistemas, Biología Sintética y Biología Computacional, además de dedicar nuestros recursos a la incorporación de nuevos científicos, a la adquisición de equipos, y a actividades relacionadas con la transferencia tecnológica, la formación, y la divulgación.
El programa Severo Ochoa reforzará la ventaja competitiva y seña de identidad del CNB como centro multidisciplinar que desarrolla y aplica tecnología puntera para resolver problemas relacionados con la salud humana y animal, la agricultura y el medioambiente.
Nuevos datos sobre cómo las bacterias infectan a las plantas
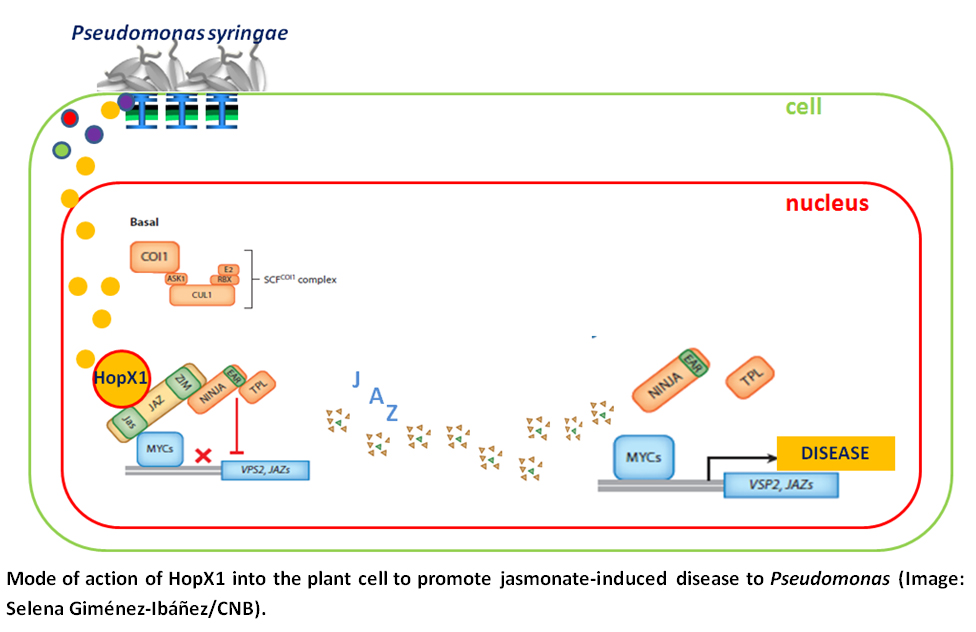
Las bacterias que atacan a las plantas, además de secretar toxinas, inyectan en las células vegetales proteínas efectoras que favorecen la infección. Algunas cepas de Pseudomonas producen una toxina llamada coronatina que desorganiza la fisiología de la célula e impide el funcionamiento de sus defensas. La coronatina imita el funcionamiento de una de las hormonas encargadas de activar las defensas contra los hongos, el jasmonato. Pero, al mismo tiempo, promueve el crecimiento bacteriano al inhibir los mecanismos de defensa dependientes del ácido salicílico, los cuales son fundamentales para resitir las infecciones por Pseudomonas.
El grupo dirigido por Roberto Solano en el Centro Nacional de Biotecnología del CSIC intenta elucidar cómo las cepas de Pseudomonas que no producen coronatina, la mayoría de ellas, son capaces de alterar las hormonas de las plantas y qué mecanismos han evolucionado para que puedan infectarlas.
Aparte de las fitotoxinas, las cepas de Pseudomonas producen hasta 30 proteínas efectoras de tipo III distintas que son capaces de suprimir de forma activa las defensas de las plantas infectadas. Para el caso concreto de uno de estos efectores, HopX1, Solano acaba de encontar en su laboratorio del CNB que en la planta modelo Arabidopsis, tanto la expresión exógena de HopX1 como la infección natural por cepas de Pseudomonas que producen este efector, promueven el crecimeinto bacteriano de manera similar a la coronatina: activando la expresión de los genes dependientes del jasmonato. Sus resultados indican que HopX1 es una cisteína proteasa que imita los efectos de la coronatina al degradar a represores esenciales en el funcionamiento de la vía de señalización del jasmonato, las llamadas proteínas jasmonate-ZIM domain (JAZ).
Estos resultados, publicados en la revista PLoS Biology, muestran un mecanismo hasta ahora desconocido por el que los patógenos manipulan los puntos clave de la respuesta hormonal que usan las plantas para protegerse frente a las infecciones.
- Gimenez-Ibanez S, Boter M, Fernández-Barbero G, Chini A, Rathjen JP, Solano R. The bacterial effector HopX1 targets JAZ transcriptional repressors to activate jasmonate signaling and promote infection in Arabidopsis. PLoS Biol. 2014; 12(2): e1001792.
Selena Giménez-Ibáñez, becada internacional por el Programa L'Oréal-UNESCO for Women in Science
La científica del Centro Nacional de Biotecnología del CSIC (CNB) Selena Giménez-Ibáñez ha sido becada en la 16º edición internacional del Programa L'Oréal-UNESCO For Women in Science. Giménez-Ibáñez se convierte de este modo en la tercera española becada en los 16 años de este programa.
 Selena Gimánez-Ibáñez estudió Ingeniería Agrónoma en la Universidad Politécnica de Valencia y obtuvo su doctorado en The Sainsbury Laboratory (Norwich, Reino Unido), uno de los principales centros europeos en investigación de enfermedades en plantas, donde se especializó en fitopatología vegetal y mecanismos de resistencia de plantas a enfermedades.
Selena Gimánez-Ibáñez estudió Ingeniería Agrónoma en la Universidad Politécnica de Valencia y obtuvo su doctorado en The Sainsbury Laboratory (Norwich, Reino Unido), uno de los principales centros europeos en investigación de enfermedades en plantas, donde se especializó en fitopatología vegetal y mecanismos de resistencia de plantas a enfermedades.
Desde hace tres años trabaja en el CNB con el profesor Roberto Solano, intentando descubrir nuevos componentes de defensa en las plantas y cómo transferirlos a especies agronómicas con importancia económica. "Hacemos grandes esfuerzos por movilizar los descubrimientos del laboratorio al campo, y de ahí a la sociedad", afirma Selena.
Su trabajo se centra en averiguar los mecanismos de defensa de las plantas contra los microbios que las rodean, así como descubrir los mecanismos que utilizar ciertas bacterias patógenas para infectar a las plantas.
Sus logros más relevantes en los últimos años se han basado en la caracterización del sistema inmune de las plantas -el llamado sistema inmune basal-. Las plantas tienen unos 600 receptores que lo ven todo, son como ojos encargados de ver lo que pasa fuera y responder adecuadamente a cada estímulo. Precisamente, el segundo hito de su investigación es haber identificado moléculas microbianas que destruyen estos receptores para cegar a las plantas y poder hacer con ellas lo que quieran, es decir, causar una enfermedad. Muy recientemente, Selena ha demostrado que esas moléculas microbianas son capaces también de manipular las hormonas de las plantas y dejarlas desorientadas, lo que es completamente necesario para lograr la infección.
Convencida de que en la ciencia se esconden las respuestas de la mayoría de los problemas económicos actuales, el objetivo final de Selena Giménez-Ibáñez es solucionar el gran problema de las pérdidas de producción que se producen cada año por culpa de la plagas de enfermedades. "La FAO estima que aproximadamente el 10% de la producción mundial se pierde por enfermedades. Así que cualquiera puede imaginar el problema tan grave al que nos enfrentamos en un mundo con población creciente y grandes focos de hambre en el tercer mundo", explica la joven científica.
Respecto a la beca L’Oréal-UNESCO For Women in Science que recibirá en París el próximo 19 de marzo, destaca que le permitirá abrir su actual proyecto en curso, en áreas nuevas, manteniendo mis principales intereses científicos. "El objetivo es ir a un grupo líder de investigación como el de Dr. Vardis Ntoukakis en Inglaterra. Allí están haciendo cosas muy novedosas que permitirán solucionar problemas agronómicos que padecemos ahora".
