
XXI Workshop Avances en Biología Molecular por Jóvenes Investigadores en el Extranjero
El Centro Nacional de Biotecnología del CSIC celebra en Madrid el jueves 19 de diciembre de 2013 la vigesimoprimera edición de su tradicional jornada Avances en Biología Molecular por Jóvenes Investigadores en el Extranjero.
Las jornadas incluyen este año una mesa redonda en la que se comentarán las distintas posibilidades de financiación a nivel europeo.
PROGRAMA

Semana de la Ciencia 2013
Como el resto de centros del CSIC, el CNB participa activamente en la Semana de la Ciencia y la Tecnología, un hito anual de divulgación científica que se celebra en España desde 2001.
Estas son las actividades de este año en las que participan los investigadores del CNB:
- 5 de noviembre de 2013 (9:30 - 12:00). Visita guiada al CNB.
- 5 de noviembre de 2013 (12:00). El Puzzle del Cerebro. Charla divulgativa a cargo de Rosario Fernández.
- 12 de noviembre de 2013 (9:30 - 12:00). Visita guiada al CNB.
- 14 de noviembre de 2013 (15:30 - 17:00). Visita guiada al CNB.
- 14 de noviembre de 2013 (17:00). ¿Puede la Biotecnología curar las Enfermedades Raras? Mesa redonda con la participación de Lluís Montoliu

Patentadas en EE.UU. bacterias capaces de inyectar anticuerpos
Investigadores del Centro Nacional de Biotecnología del CSIC (CNB) han obtenido una patente en los Estados Unidos que les permite utilizar bacterias no patógenas como si de jeringuillas microscópicas se trataran.
Las bacterias modificadas tienen en su membrana unas proteínas a modo de jeringuilla con las que son capaces de inyectar anticuerpos de pequeño tamaño (nanoanticuerpos) y otras proteínas con potencial terapéutico (p.ej. enzimas) a células humanas, evitando de esta manera la barrera que representa la membrana plasmática de la célula. En el caso de usar nanoanticuerpos, estos se podrían unir dentro de la célula a una proteína diana que participase en un proceso patológico para inactivar su función.
Para comprobar la viabilidad de esta tecnología, el grupo dirigido en el CNB por el Dr. Luis Ángel Fernández, introdujo estos nanoanticuerpos en el citoplasma de células humanas demonstrando que se unían especificamente a su proteína diana.
Una de las principales ventajas de este sistema es que la producción de los nanoanticuerpos la realiza la propia bacteria de manera continua, lo que podría reducir el coste y el número de dosis necesario para administrar estos anticuerpos de forma efectiva. Fernández recalca además su seguridad, ya que la inyección de los anticuerpos por parte de E. coli no conlleva ni la invasión de la células por parte de las bacterias ni la transferencia de manterial genético, al contrario que lo que ocurre con virus modificados.
El objetivo actual de este grupo de investigación es combinar estas jeringas moleculares en bacterias "probióticas" con nuevas modificaciones de forma que actuasen en el intestino y otras mucosas del organismo como autenticos "microrobots" dirigidos tanto para la detección como el tratamiento in situ de lesiones de tipo inflamatorio o tumoral.
- Luis Ángel Fernández y Ana Blanco-Toribio. Una bacteria recombinante capaz de inyectar anticuerpos monodomino intracelularmente en células humanas. Ref. CSIC/AH_015.

Chromatography for Proteomics [CANCELLED]
THIS COURSE HAS BEEN CANCELLED.
Organised by the EuPA Education Committee, Proteored-ISCIII and the Spanish Proteomics Society, from 4 to 8 Novembre 2013 the basic course Chromatography for Proteomics will be held in Madrid at the National Centre for Biotechnology-CSIC and the Faculty of Pharmacy-UCM.
In accordance with the HUPO/EuPA guidelines, the course aim to
- Provide a theoretical basis for understanding chromatographic separations
- Illustrate how the techniques are being applied in modern proteomics studies
- Help students to design their own experiments
- Provide practical instruction in laboratory techniques
- Provide extensive tutorial/discussion sessions
Course Description:
There are two main separation methods used in modern proteomics, electrophoresis and chromatography. The course is part of a series designed to give researchers a thorough basis to understand the new trends in protein expression analysis and to enable scientists entering the field to evaluate how useful these new techniques are to their own research and how to apply them effectively.
Theoretical Lectures:
- Basic liquid chromatography terms and theory
- Methods for separating protein and peptide mixtures
- Designing multi-dimensional separations
- Mass Spectrometry and database searching
Practical Classes:
- Sample preparation and extraction
- Evaluating and optimising separations
- Making nanocolumns, plumbing and HPLC troubleshooting
For inscriptions (before 21 September 2013), visit the website of the Chromatography for Proteomics.
VII Ciclo de Seminarios Júnior
XVIII Ciclo de Seminarios del CNB
Dido controla la proliferación y diferenciación de las células madre
Las células "madre" embrionarias reciben este nombre por su capacidad de generar cualquier tipo celular de las tres capas del embrión a partir de las cuales se originarán los tejidos y órganos en el individuo adulto: el endodermo, el mesodermo o el ectodermo (diferenciación). Además, y al contrario que las células adultas especializadas, las células madre tienen la asombrosa capacidad de poder multiplicarse indefinidamente en el laboratorio (división), lo que las hace tremendamente útiles en el campo de la medicina regenerativa.
 En la actualidad, los científicos tratan de comprender los mecanismos moleculares que regulan en las células madre el equilibrio entre ambos procesos, la división y la diferenciación. Últimamente se han identificado genes que permiten reprogramar células especializadas y convertirlas en células madre pero aun hay muchos genes específicos de estas células cuya función es desconocida.
En la actualidad, los científicos tratan de comprender los mecanismos moleculares que regulan en las células madre el equilibrio entre ambos procesos, la división y la diferenciación. Últimamente se han identificado genes que permiten reprogramar células especializadas y convertirlas en células madre pero aun hay muchos genes específicos de estas células cuya función es desconocida.
Un ejemplo es el gen Dido al que dedica sus esfuerzos el grupo del Centro Nacional de Biotecnología del CSIC (CNB) dirigido por Carlos Martínez-A. Este gen aparece evolutivamente en vertebrados y se manifiesta en tres proteínas distintas: Dido1, Dido2 y Dido3. Esta última se expresa en células madre y se modula su expresión en las células especializadas. Se une a estructuras esenciales para la división celular como son el centrosoma y el complejo sinaptonémico. Alteraciones de esta proteína causan síndromes preleucémicos y tumorales y bloquean la capacidad de diferenciarse de las células madre en cualquier tipo celular específico (diferenciación) manteniendo su capacidad de división (proliferación).
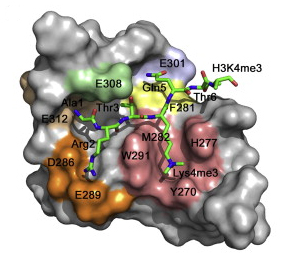
En colaboración con investigadores de la Universidad de Colorado, los científicos del CNB acaban de publicar un trabajo en el que identifican al dominio PH de Dido3, y determinan su estructura cristalina a 1.8 A de resolución, como el responsable de la unión al cromosoma. Esta unión causaría modificaciones en la expresión de diferentes genes que le dan a las células madre su capacidad de dividirse y diferenciarse en células adultas.
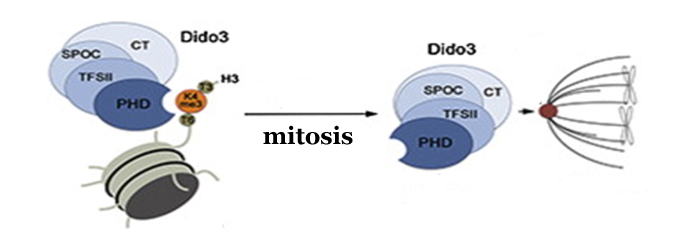
Además de identificar la zona de la proteína que se une a las histonas que organizan los cromosomas, los investigadores han profundizado en cómo se regula su función según el momento del ciclo celular en que se encuentre la célula. Sus datos indican que cuando las células madre se diferencian, Dido3 es desplazada del cromosoma por el aumento de Dido1. Esto conlleva una disminución en la expresión de genes que dotan a las células madre de su pluripotencia.
En este mismo aspecto, durante la mitosis han observado que Dido3 pasa de estar unido a la cromatina a desplazarse hasta el huso mitótico que dispone a los cromosomas en el ecuador de la célula como paso previo a separarlos hacia los polos cuando se va a producir la división de una célula en dos. De este modo, queda descrita por primera vez a través de Dido relación entre la expresión de genes durante el desarrollo embrionario y la regulación del ciclo celular
- Gatchalian J, Fütterer A, Rothbart SB, Tong Q, Rincon-Arano H, Sánchez de Diego A, Groudine M, Strahl BD, Martínez-A C, van Wely KH, Kutateladze TG. Dido3 PHD modulates cell differentiation and division. Cell Rep 2013 Jul 2. pii: S2211-1247(13)00292-1.
Identifican las primeras bases moleculares de la percepción de arsénico en plantas
La presencia de arsénico en la naturaleza debido a las erupciones volcánicas ha sido una de las amenazas más importantes para el desarrollo de la vida en la tierra. Hoy en día el arsénico presente en los suelos, puede ser solubilizado en las aguas subterráneas exponiendo a los organismos a uno de los carcinógenos más potentes que se conocen. De hecho la exposición a arsénico es responsable del envenenamiento masivo más importante que ha sufrido la humanidad en toda su historia.
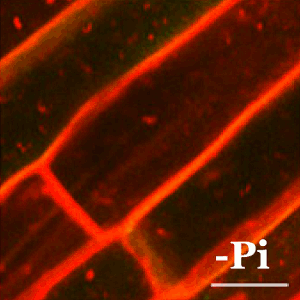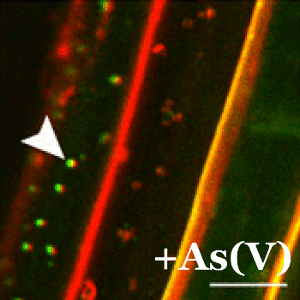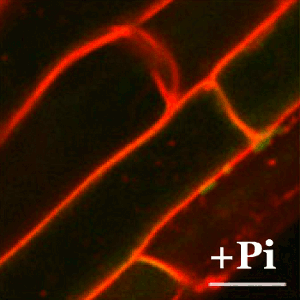 En plantas, la tolerancia al arsénico es esencial para su supervivencia ya que la forma química más abundante en la tierra (el arseniato) guarda una gran similitud con el fosfato y las plantas lo incorporan fácilmente a sus células a través de los transportadores de fosfato. En el CNB, el grupo dirigido por Antonio Leyva estudia las bases moleculares de los mecanismos de percepción de arsénico en plantas con el fin de identificar y desarrollar plantas que eviten la exposición de este carcinógeno a los seres vivos.
En plantas, la tolerancia al arsénico es esencial para su supervivencia ya que la forma química más abundante en la tierra (el arseniato) guarda una gran similitud con el fosfato y las plantas lo incorporan fácilmente a sus células a través de los transportadores de fosfato. En el CNB, el grupo dirigido por Antonio Leyva estudia las bases moleculares de los mecanismos de percepción de arsénico en plantas con el fin de identificar y desarrollar plantas que eviten la exposición de este carcinógeno a los seres vivos.
En este trabajo, merecedor de un comentario especial por parte de los editores de la revista Plant Cell, el grupo de Leyva ha descubierto que cuando las plantas detectan el arseniato impiden de forma inmediata su captación mediante la represión y deslocalización del transportador de fosfato. Este sistema está controlado mediante la acción de una proteína represora conocida como WRKY6.
En colaboración con otros dos grupos del CNB, han podido además descubrir que el arseniato provoca la activación masiva de transposones, unos elementos del ADN móviles capaces de “saltar” de un sitio a otro del genoma en respuesta a estrés y por tanto actuar como agentes mutagénicos. Una activación que también está controlada por el represor WRKY6.
Estos resultados indican que las plantas poseen un mecanismo de percepción del arseniato que controla la activación de transposones y la incorporación del arseniato. Todo ello proporciona un sistema integrado de tolerancia y de estabilidad genómica.
- Castrillo G, Sánchez-Bermejo E, de Lorenzo L, Crevillén P, Fraile-Escanciano A, Tc M, Mouriz A, Catarecha P, Sobrino-Plata J, Olsson S, Leo Del Puerto Y, Mateos I, Rojo E, Hernández LE, Jarillo JA, Piñeiro M, Paz-Ares J, Leyva A. WRKY6 transcription factor restricts arsenate uptake and transposon activation in Arabidopsis. Plant Cell 2013 Aug 6 tpc.113.114009.
IV Curso de Proteómica Cuantitativa
Organizado por el Servicio de Proteómica del Centro Nacional de Biotecnología del CSIC, del 7 al 11 de octubre de 2013 se va a celebrar en Madrid el IV Curso de Proteómica Cuantitativa.
 Este curso de Proteómica Cuantitativa pretende ofrecer una exhaustiva visión teórica y práctica de algunas las aproximaciones experimentales más utilizadas en proteómica diferencial. Como puede comprobarse en el programa del curso, a lo largo de cuatro días se analizarán en detalle técnicas como el marcaje isotópico diferencial con reactivos como ICPL (Isotope-coded protein labelling) y iTRAQ, seguido de fraccionamiento por cromatografía líquida y análisis mediante espectrometría de masas y técnicas de proteómica cuantitativa dirigida (MRM).
Este curso de Proteómica Cuantitativa pretende ofrecer una exhaustiva visión teórica y práctica de algunas las aproximaciones experimentales más utilizadas en proteómica diferencial. Como puede comprobarse en el programa del curso, a lo largo de cuatro días se analizarán en detalle técnicas como el marcaje isotópico diferencial con reactivos como ICPL (Isotope-coded protein labelling) y iTRAQ, seguido de fraccionamiento por cromatografía líquida y análisis mediante espectrometría de masas y técnicas de proteómica cuantitativa dirigida (MRM).
Las clases teóricas se combinarán con clases prácticas que permitirán al investigador familiarizarse con estas técnicas y descubrir todo su potencial La proteómica permite la identificación y caracterización de las proteínas presentes en proteomas y subproteomas complejos
La información más actualizada puede encontrarse en la página web del IV Curso de Proteómica Cuantitativa.
El Campus de Biociencias de Madrid Norte busca un director
El Campus de Biociencias de Madrid Norte es un proyecto del área de las Ciencias de la Vida y de la Salud del Campus de Excelencia UAM+CSIC formado por los principales agentes responsables de la I+D+ i en biociencias en el área norte de Madrid. El objetivo del Campus es crear un entorno de actividad científica a través de la colaboración entre sus agentes y empresas relacionadas para fomentar el desarrollo de colaboraciones tecnológicas en Ciencias de la Vida y la Salud.
 La principal función del Director/a será poner en marcha, dirigir y administrar el Campus. Será el responsable de negociar con los diferentes agentes involucrados y promover colaboraciones nacionales e internacionales en línea con la estrategia del Campus de Excelencia.
La principal función del Director/a será poner en marcha, dirigir y administrar el Campus. Será el responsable de negociar con los diferentes agentes involucrados y promover colaboraciones nacionales e internacionales en línea con la estrategia del Campus de Excelencia.
Requisitos:
- Licenciado/a o doctor/a. Se valorará la formación en Ciencias de la Vida.
- Experiencia demostrable en gestión, promoción, evaluación y coordinación de actividades de I+D+i en ciencias y tecnología y en transferencia de resultados. Se valorará experiencia científica.
- Experiencia en planificación y gestión estratégica de Centros de Excelencia públicos o privados, fundaciones de investigación, institutos de saludo pública o entidades públicas.
- Liderazgo y visión estratégica.
- Conocimiento del entorno científico empresarial, especialmente en el ámbito de la salud. Se valorará positivamente experiencia en el sector de la biotecnología y del sector de la salud en España, y en Madrid, en particular.
- Conocimiento de las políticas nacionales e internacionales en biociencias y en I+D+ i.
- Conocimiento de la red nacional e internacional de instituciones públicas y privadas en biociencias
- Inglés y Español fluidos.
Se precisa incorporación inmediata, dedicación completa y disponibilidad para viajar.
Modalidad contractual: contrato por obra o servicio.
Jornada: completa.
Retribución: a convenir en función de la valía el candidato seleccionado.
La selección de los candidatos se realizará mediante la valoración del curriculum, entrevista personal y la valoración de la memoria estratégica que se solicitará en la primera entrevista.
Fecha límite para entrega de candidaturas: jueves 31 de julio hasta las 14.00 horas.
Dirigir las solicitudes por correo electrónico a o por correo postal a la FUAM, Calle Einstein, nº 13, planta 2ª. 28049 MADRID.
Indicar referencia: DCBNM.
*El puesto podrá declararse desierto si la FUAM considera que ninguno de los candidatos cumple los requisitos.


