
Nuevo papel de la interleuquina 4 en alergias
La producción de interleuquina 4 (IL-4) por parte tanto de basófilos como de linfocitos de tipo Th2 es uno de los pasos clave en la respuesta contra helmintos. Sin embargo, la producción de IL-4 también forma parte de las reacciones alérgicas, las cuales pueden llegar a producir cuadros clínicos severos como el asma o la anafilaxis.
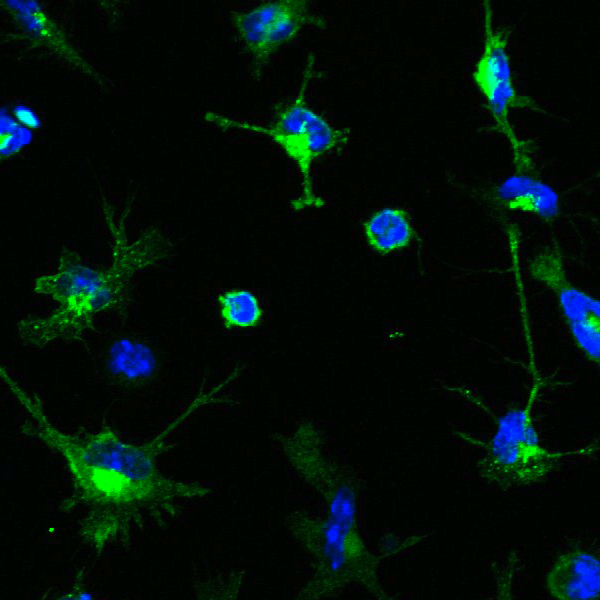 Estudiando el papel de la IL-4 en la respuesta inmunitaria de tipo TH2, el grupo del Centro Nacional de Biotecnología del CSIC (CNB) dirigido por Carlos Ardavín ha descubierto que esta citoquina modula la función de las células dendríticas. En su trabajo, publicado en la revista Journal of Allergy and Clinical Immunology, describen tanto los genes de las células dendríticas regulados por la IL-4 como los mecanismos moleculares que regulan este proceso.
Estudiando el papel de la IL-4 en la respuesta inmunitaria de tipo TH2, el grupo del Centro Nacional de Biotecnología del CSIC (CNB) dirigido por Carlos Ardavín ha descubierto que esta citoquina modula la función de las células dendríticas. En su trabajo, publicado en la revista Journal of Allergy and Clinical Immunology, describen tanto los genes de las células dendríticas regulados por la IL-4 como los mecanismos moleculares que regulan este proceso.
Analizando la respuesta de las céllulas dendríticas a los ligandos provenientes de patógenos que se unen a los receptores de tipo Toll, Ardavín y su grupo observaron que la IL-4 bloqueaba en las células dendríticas la expresión de los genes relacionados con la inducción de las reacciones inflamatorias y la polarización de la respuesta inmune de tipo Th1. Esto se produce a través de la hipoacetilación de las histonas situadas en las regiones promotoras de estos genes, con lo que se licencia a las células dendríticas a que induzcan una reacción alérgica de tipo Th2 en respuesta a los alergenos de los ácaros del polvo.
- López-Bravo M, Minguito de la Escalera M, Domínguez PM, González-Cintado L, del Fresno C, Martín P, Martínez del Hoyo G, Ardavín C. IL-4 blocks TH1-polarizing/inflammatory cytokine gene expression during monocyte-derived dendritic cell differentiation through histone hypoacetylation. J Allergy Clin Immunol. 2013; 132(6): 1409-1419.
Redes de regulación genética en plantas
Uno de los mayores retos de la era post-genómica es el de descifrar cómo se regula en los seres vivos la expresión de todos los genes. En el caso de las plantas, sabemos que los factores de transcripción se unen a miles de fragmentos distintos del ADN y que solo algunas de estas unionen inician la expresión de estos genes. Algo que dificulta enormemente averiguar cuáles son las secuencias clave para que se produzca o no una proteína.
En el Centro Nacional de Biotecnología del CSIC, los grupos de investigación de Roberto Solano y José M. Franco-Zorrilla, en colaboración con el grupo de Pablo Vera en el Instituto de Biología Molecular y Celular de Plantas de Valencia, han conseguido identificar en Arabidopsis thaliana la secuencia diana específica de 63 factores de transcripción. Para ello han tenido que desarrollar unas matrices de hibridación de alta capacidad (microarrays). Para poder diferenciar la uniones biológicamente significativas, analizaro también los genes regulados por mutantes de estos factores de transcripción y analizaron los datos del transcriptoma de los mismos. Combinando las secuencias de ADN con los datos obtenidos de la expresión de los genes, han conseguido hacer una serie de predicciones que indican el papel de cada factor de transcripción bien como activador, bien como represor de la expesión de genes concretos.
Estos resultados, que acaban de publicar en la revista Proceedings of the National Academy of Sciences USA, muestran que con los microarrays desarrollados en la Unidad de Genómica del CNB son capaces de identificar la especificidad de unión de los factores de transcripción al ADN. este nuevo método es mejor que los anteriores tanto por su precisión como por su capacidad de analizar grandes cantidades de secuencias. De hecho, la tecnología desarrollada por Franco-Zorrilla y Solano ha sido ya empleada en un estudio publicado en la revista Cell en el que descubren un mecanismo molecular por el que la auxina controla el crecimiento y desarrollo de las plantas.
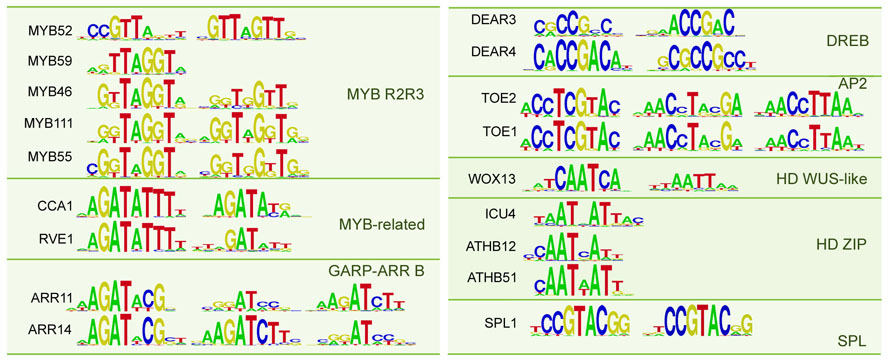
- Franco-Zorrilla JM, López-Vidriero I, Carrasco JL, Godoy M, Vera P, Solano R. DNA-binding specificities of plant transcription factors and their potential to define target genes. Proc Natl Acad Sci USA. 2014; 111(6): 2367-2372.
- Boer DR, Freire-Rios A, van den Berg WA, Saaki T, Manfield IW, Kepinski S, López-Vidrieo I, Franco-Zorrilla JM, de Vries SC, Solano R, Weijers D, Coll M. Structural basis for DNA binding specificity by the auxin-dependent ARF transcription factors. Cell. 2014; 156(3): 577-589.
Resfriarse depende de las interacciones entre el ARN y las proteínas del virus
Los rhinovirus humanos son los causantes del resfriado común, una enfermedad contagiosa ampliamente extendiada y que, debido al coste de la medicación y al absentismo laboral que causa, supone un impacto económico elevado. Al no existir un tratamiento efectivo, la medicación actual tan solo alivia los síntomas que nos causa.
 El grupo de investigación del Centro Nacional de Biotecnología del CSIC dirigido por José R. Castón estudia como los rhinovirus humanos consiguen liberar su genoma al citoplasma de la célula a la que infectan, paso previo imprescindible para poder así iniciar su multiplicación. Para ello, mediante crio-microscopía y cristalografía de rayos X, estudian los cambios que sufre el virus durante el proceso infectivo.
El grupo de investigación del Centro Nacional de Biotecnología del CSIC dirigido por José R. Castón estudia como los rhinovirus humanos consiguen liberar su genoma al citoplasma de la célula a la que infectan, paso previo imprescindible para poder así iniciar su multiplicación. Para ello, mediante crio-microscopía y cristalografía de rayos X, estudian los cambios que sufre el virus durante el proceso infectivo.
En colaboración con los grupos de Dieter Blaas (Max F. Perutz Laboratories de la Medical University of Vienna), de Nuria Verdaguer (Instituto de Biología Molecular de barcelona-CSIC) y de Benes L. Trus (National Institutes of Health en Bethesda, EE.UU.), Castón ha observado una serie de cambios sustanciales que se producen cuando los rhinovirus se hacen infectivos. En concreto, en los contactos entre el ARN y las proteínas del virus durante uno de los pasos intermedios de este cambio, la partícula A. Cabe destacar además que estas modificaciones en la parte interior de la partícula viral A provocan unos cambios fundamentales en la conformación del ARN de virus, que pasa a estar organizado a modo de capa bajo la cubierta proteica.
Estos datos, que acaban de publicarse en la revista Proceedings of the National Academy of Sciences USA, apoyan un modelo en el que para que el genoma pase de forma eficiente al citoplasma de la célula infectada, antes el ARN debe abandonar su estado relajado inicial y contactar con la membrana proteica. Solo así podrá dirigirse de forma dinámica hacia el poro por el que saldrá.
Como se puede apreciar en el siguiente vídeo, el virus nativo (azul) sufre una serie de cambios conformacionales y progresa hacia la partícula A (verde). Estos cambios, tanto de la cápsula proteica como del ARN, se siguen produciendo hasta que el virus adquiere la forma infectiva como partícula B (naranja).
- Pickl-Herk A1, Luque D, Vives-Adrián L, Querol-Audí J, Garriga D, Trus BL, Verdaguer N, Blaas D, Castón JR. Uncoating of common cold virus is preceded by RNA switching as determined by X-ray and cryo-EM analyses of the subviral A-particle. Proc Natl Acad Sci USA. 2013; 110(50): 20063-20068.
85 millones de euros para desarrollar nuevos antibióticos
A través de la participación del Centro Nacional de Biotecnología (CNB) y del Centro de Investigaciones Biológicas (CIB), el CSIC participa en una iniciativa, junto a más de 30 universidades europeas, institutos de investigación y empresas, para desarrollar nuevos antibióticos frente a patógenos Gram- negativos. El programa, denominado ENABLE, tiene una duración de 6 años y está liderado por GlaxoSmithKline y la Universidad de Uppsala. Cuenta además con el apoyo de la Iniciativa sobre Medicamentos Innovadores (IMI).
 La crisis de los antibióticos
La crisis de los antibióticos
El mundo se enfrenta a una creciente epidemia de resistencia a los antibióticos, sin embargo sólo se han introducido en el mercado dos nuevas clases de antibióticos en los últimos 30 años. El descubrimiento y desarrollo de nuevos antibióticos es esencial para mantener los avances médicos, pero plantea retos científicos, clínicos y financieros importantes, en particular para los antibióticos activos contra las bacterias Gram- negativas (como E. coli). Estas bacterias tienen barreras eficaces contra las drogas, su tratamiento resulta difícil, y adquieren resistencias con facilidad. Los nuevos antibióticos que se descubren han de ser siempre utilizados con precaución para retrasar la aparición de resistencias en los microbios que se quieran tratar, por lo que se dificulta la amortización de las inversiones realizadas para su desarrollo.
 Colaboración privada y pública
Colaboración privada y pública
En respuesta a estas barreras en el desarrollo de nuevos antibióticos, IMI, una asociación de investigación entre la Comisión Europea y las principales compañías farmacéuticas (a través de la EFPIA, la Federación Europea de Industrias y Asociaciones Farmacéuticas), ha puesto en marcha una serie de proyectos llamados ND4BB, unas siglas con cierta gracia en lengua inglesa que significan “nuevas drogas para bichos malos”. Su propósito es superar los cuellos de botella en el desarrollo de nuevos antibióticos y propugnar que se usen de forma eficaz.
El proyecto ENABLE, el tercero en la serie ND4BB, agrupa 13 países y reúne a 32 socios con la misión de establecer una importante herramienta para encontrar fármacos antibacterianos promocionando el avance de los programas de investigación a través del descubrimiento de nuevos compuestos y de la realización de la primera fase de ensayos clínicos. La cartera de compuestos inicial se ampliará a través de convocatorias abiertas para mantener un flujo de desarrollo que logre así el objetivo final que es completar esa primera fase de ensayos clínicos para obtener en 2019 al menos un antibiótico nuevo para tratar las infecciones por bacterias Gram- negativas.
La inversión conjunta pública y privada a través de IMI responde a cambios en la estrategia para obtener algunos medicamentos que, como los antibióticos, necesitan una inversión arriesgada para su descubrimiento y desarrollo. Esta colaboración tiene la misión de movilizar en Europa la experiencia de las universidades, institutos de investigación y la industria para responder a los desafíos globales. Coloca a Europa en la vanguardia de la investigación en colaboración entre la industria y el mundo académico para responder a los retos que presenta la salud.
 El CNB: impedir la proliferación de patógenos
El CNB: impedir la proliferación de patógenos
“Estudiando la bacteria E. coli como modelo, en el Centro Nacional de Biotecnología del CSIC,” manifiesta Miguel Vicente, “hemos obtenido conocimientos y experiencia técnica del más alto nivel para ensayar la eficacia de nuevos antibióticos en la lucha contra patógenos Gram-negativos”. A lo largo del proyecto ENABLE el CNB recibirá compuestos desarrollados por otros socios, como la fundación MEDINA, la Universidad de Barcelona y la empresa Biomol-Informatics para determinar si frenan el crecimiento o la proliferación de la bacteria. “Cuando lo sepamos, realizaremos ensayos más detallados para averiguar si alguno de ellos bloquea la máquina molecular que dirige la división de la bacteria y así proponer modificaciones de su estructura química que los hagan más eficaces”.
La diabetes podría llegar a tratarse con hormona del crecimiento
Cuando nuestro propio sistema inmune ataca a las células del páncreas encargadas de producir insulina no hay mucho que podamos hacer. Tenemos diabetes de tipo 1, y el único recurso que tienen los médicos es el de recetarnos insulina para que nos la inyectemos.
 Sin embargo, a pesar de que con la insulina podemos tener contralada la diabetes, no existe cura y, con los años, la diabetes puede acabar acarreando complicaciones serias: problemas oculares, úlceras e infecciones en las extremidades, presión arterial y colesterol altos, o problemas renales.
Sin embargo, a pesar de que con la insulina podemos tener contralada la diabetes, no existe cura y, con los años, la diabetes puede acabar acarreando complicaciones serias: problemas oculares, úlceras e infecciones en las extremidades, presión arterial y colesterol altos, o problemas renales.
En su laboratorio del Centro Nacional de Biotecnología del CSIC, el grupo de investigación dirigido por Mario Mellado ha identificado una manera que evita que el sistema inmune ataque a las células del páncreas. Empleando un modelo murino de la enfermedad, los resultados que han obtenido parecen bastante prometedores: la hormona del crecimiento, usada por los médicos desde los años 50 del siglo pasado para tratar de su deficiencia a niños y adolescentes, retrasa el desarrollo de la diabetes de tipo 1.
En colaboración con científicos de la Universidad Complutense, han demostrado que la hormona de crecimiento favorece la proliferación de los islotes pancreáticos, protege su integridad y tiene efectos sobre el sistema inmunológico, favoreciendo la presencia de macrófagos antiinflamatorios y, entre otras cosas, mantiene la actividad de la población de linfocitos T encargada de reducir la respuesta inmune (células T reguladoras). Como acaban de publicar en la revista PNAS, el estudio remarca la importancia del control endocrino del las funciones asociadas al sistema inmunológico y sugiere que terapias basadas en análogos de la hormona de crecimiento podrían ser útiles en le tratamiento de la diabetes autoinmune.
- Villares R, Kakabadse D, Juarranz Y, Gomariz RP, Martínez-A C, Mellado M. Growth hormone prevents the development of autoimmune diabetes. Proc Natl Acad Sci USA. 2013; 110(48): E4619-E4627.
3rd Madrid Meeting on Dendritic Cells and Macrophages
Colloquium on Cellular Decision Making
Many cellular processes can in the end be understood in terms of decisions; should a damaged cell decide to repair or to die? should a virus stay as a lysogen or rather cause host lysis? should a bacteria differentiate or not into a spore state when nutrients become limiting? Recent research is starting to understand these type of decisions by applying quantitative measurements and mathematical modeling. Notably, in many of these scenarios cellular 'strategies' that combined biological noise and nonlinearities in response are starting to be unravelled.
On 24 January 2014, the CNB Systems Biology Programme is bringing a number of experts on these very topics next week as part of its annual colloquium, with talks including aspects of decision making in mammalian cells, plants, microbes, etc. (see programme), so we expect that this meeting could be of interest for a wide range of life sciences scientists. You are all most welcome to attend.
PROGRAMME
Morning Session I (Chairman: Víctor de Lorenzo)
09:45 Welcome and General Information
10:00 - WILFRIED WEBER, University of Freiburg, Germany. Optical Control of Mammalian Cells
10:30 - ALEX DE MENDOZA, EB UPF-CSIC, Spain. Comparative genomics at the origins of multicellularity: transcription factors and signaling systems
11:00 - FRANCISCO ROMERO-CAMPERO, University of Seville, Spain. Plant development evolution based on gene co-expression networks
11:30 Coffee Break
Morning Session II (Chairman: Juan F Poyatos)
12:00 - PETER SWAIN, University of Edinburgh, UK. Microbial decision-making: phosphorylations and mating in yeast
12:30 - THIERRY EMONET, Yale University, USA. Functional trade-offs and phenotypic diversity in cellular migration
13:00 – EDO KUSSELL, New York University, USA. Memory accelerates bacterial adaptation in fluctuating environments
13:30 Lunch
Afternoon Session I (Chairman: Florencio Pazos)
14:30 - FERNANDO CASARES, CABD (CSIC-U. Pablo de Olavide), Spain. Gene Network Wiring and Eye Architectures in Drosophila
15:00 - CARSTEN PETERSON, Lund University, Sweden. Transcriptional regulation of lineage commitment in hematopoiesis - a stochastic model of cell fate decision
15:30 - NADIA MERCADER, CNIC, Spain. Cardiac regeneration vs. fibrotic repair: learning from the zebrafish
16:00 Coffee Break
Afternoon Session II Chairman: (Javier Tamames)
16:30 - MARTIN ACKERMANN, ETH, Switzerland. An Evolutionary Perspective on Bacterial Individuality
17:00 General Discussion and Conclusions
VIII Reunión de la Red de Estructura y Función de Proteínas
Del 2 al 4 de abril de 2014 se va a celebrar en el Centro Nacional de Biotecnología del CSIC (CNB) VIII Reunión de la Red Nacional de Estructura y Función de Proteínas.
 Organizada por los científicos del CNB José María Valpuesta y José L. Carrascosa, la reunión pretende reunir a gran parte de la comunidad científica española que estudia distintos aspectos de las proteínas, para intercambiar conocimientos y fomentar colaboraciones. En esta reunión seguirá el formato de las anteriores, con charlas cortas que permitan mostrar los resultados al mayor número posible de investigadores, dando preferencia para las charlas a investigadores junior.
Organizada por los científicos del CNB José María Valpuesta y José L. Carrascosa, la reunión pretende reunir a gran parte de la comunidad científica española que estudia distintos aspectos de las proteínas, para intercambiar conocimientos y fomentar colaboraciones. En esta reunión seguirá el formato de las anteriores, con charlas cortas que permitan mostrar los resultados al mayor número posible de investigadores, dando preferencia para las charlas a investigadores junior.
Para la organización de la reunión se cuenta con la ayuda del Ministerio de Economía y Competitividad y con apoyo por parte del Centro Nacional de Biotecnología y de varias sociedades científicas (SEBBM y SME) y empresas colaboradoras de la Red (Bruker, Sigma-Aldrich y Diffractia). Todo ello ha permitido la invitación de varios científicos que abrirán los simposios de la Reunión (ver Programa provisional).
La asistencia a la reunión será por cuenta de los investigadores participantes, tal como ha ocurrido en anteriores eventos, aunque habrá un número de ayudas a la asistencia para investigadores, financiadas por distintas sociedades científicas, cuyo número y cuantía está aun por determinar.

XXI Jornadas Científicas del CNB
La vigésima primera edición de las tradicionals Jornadas Científicas del CNB se celebrará este año los días 17 y 18 de diciembre de 2013. Como se puede apreciar en el programa, 23 científicos del CNB explicarán sus investigaciones, siendo una magnífica oportunidad de ponerse al día de las investigaciones que se llevan a cabo en la actualidad en el campo de las ciencias de la vida.
Como en años anteriores, desde el 9 de diciembre, se desarrolla en paralelo una sesión de pósters en la que los estudiantes de doctorado muestran sus trabajos. Tras la sesión presencial del jueves 12 de 11:00 a 13:00, se elegirán los dos mejores que darán una charla en la última sesión del miércoles 18 de diciembre.
PROGRAMA

Cell Division Reconstruction workshop
Packing bacterial components in unusual containers allows to explore how complex machineries work without the limitations imposed when using the whole cell. This approach, central to Miguel Vicente's HFSP grant, has produced valuable information on the cell division machinery, the divisome. New interactions between elements of the machinery have been revealed and functional assemblies have been reconstructed in the test tube.
On 28 February 2014 they will summarize the results of their project and discuss future Synthetic Biology developments in this field during a one day workshop at the Spanish National Centre for Biotechnology in Madrid. For more information and registration please visit the workshop's website.
PROGRAMME
10:00 Registration
10:30 - PETRA SCHWILLE. The contractile ring - facts and fiction
11:15 - WILLIAM MARGOLIN. Inhibiting the proto-ring, from A to Z
12:00 - MARTIN THANBICHLER. Mechanisms of MipZ-mediated division control in Caulobacter crescentus
13:15 Lunch
14:30 - MIGUEL VICENTE. Divisome adventures in maxicells
15:15 - GERMÁN RIVAS. Biochemical reconstruction of bacterial division in minimal systems
16:00 - DANIEL DALEY. The final stages of cell division in Escherichia coli: What happens and when?


