
La Caixa International PhD Fellowship Programme 2015
Since 2008 Obra Social ‘la Caixa’ fund an International PhD Fellowship Programme to provide highly talented PhD students with a unique opportunity to start a scientific career at the Spanish National Biotechnology Centre (Centro Nacional de Biotecnología, CNB).
2015 call
 The Spanish National Biotechnology Centre (Centro Nacional de Biotecnología, CNB) offers three 4-year working contracts, funded by Obra Social ‘la Caixa’, to provide highly talented PhD students with a unique opportunity to start a scientific career at one of the Spanish ‘Severo Ochoa’ Centres of Excellence. Working contracts will begin between September and October 2015 and include an annual gross salary that increases progressively from €18,546 in the first year to €22,558 in the fourth year, with an annual allowance for thesis-related expenses (€1,500 in the first and second years, €1,700 in the third and fourth years), and full social insurance coverage.
The Spanish National Biotechnology Centre (Centro Nacional de Biotecnología, CNB) offers three 4-year working contracts, funded by Obra Social ‘la Caixa’, to provide highly talented PhD students with a unique opportunity to start a scientific career at one of the Spanish ‘Severo Ochoa’ Centres of Excellence. Working contracts will begin between September and October 2015 and include an annual gross salary that increases progressively from €18,546 in the first year to €22,558 in the fourth year, with an annual allowance for thesis-related expenses (€1,500 in the first and second years, €1,700 in the third and fourth years), and full social insurance coverage.
Applications must be submitted to the CNB umbrella organisation, the Spanish National Research Council (Agencia Estatal Consejo Superior de Investigaciones Científicas, CSIC):
- Instructions and application form (applications until 9 February 2015)
- Guidelines to fill the forms (in English)
- Provisional list of candidates
- Initial evaluation of the candidates
- Candidates selected for the interview (15 April 2015)
- Evaluation of the interviewed candidates
Successful candidates will be contracted between September and October 2015.
Group Leader Positions at the CNB
The CNB invites applications for Group Leader positions in its Departments of Cellular and Molecular Biology (2 positions) and Plant Molecular Genetics (1 position).
Specific areas of interest are:
Cellular and Molecular Biology
- Genes and Disease
- Virus-Host Interactions
Plant Molecular Genetics
- Plant Cell Division and Differentiation
- Plant Productivity and Developmental/Environmental/Stress Response Networks
This call is targeted at scientists who wish to transfer their research group to the CNB. Group Leaders will be offered suitable office and laboratory space to accommodate research groups of up to 10 people. They will have full access to the CNB’s extensive research facilities and to dedicated support for project management, technology transfer, outreach and administrative issues.
The CNB forms part of the Spanish National Research Council (Consejo Superior de Investigaciones Científicas – CSIC) and is one of the seven Spanish ’Severo Ochoa’ Centres of Excellence in Life Sciences and Medicine. The implementation of cutting edge Computational, Systems and Synthetic Biology approaches is a strategic priority of the CNB’s research programme.
For further information, please contact with the CNB at: .
Applicants should provide the following documents (in English):
- Letter of intent
- Summary of scientific achievements including a list of 5 key publications (max. 2 pages)
- Outline of current research interests and future research projects (max. 4 pages)
- Curriculum vitae including a complete list of publications, patents and funded projects
Candidates will be evaluated by the CNB’s Scientific Advisory Board and selected solely based on their scientific merits, leadership, fund-raising capabilities and strategic fit into the centre’s scientific priorities.
Applications should be submitted by e-mail no later than March 31, 2015 to: .
XXII Jornadas Científicas del CNB
La vigésimo segunda edición de las tradicionales Jornadas Científicas del CNB se celebrará este año los días 16 y 17 de diciembre de 2014. Como se puede apreciar en el programa, 24 científicos del CNB explicarán sus investigaciones, siendo una magnífica oportunidad de ponerse al día de las investigaciones que se llevan a cabo en la actualidad en el campo de las ciencias de la vida.
Como en años anteriores, desde el 9 de diciembre, se desarrolla en paralelo una sesión de pósters en la que los estudiantes de doctorado muestran sus trabajos. Tras la sesión presencial del jueves 11 de 11:00 a 13:00, se elegirán los dos mejores que darán una charla en la última sesión del miércoles 17 de diciembre. Este año además, gracias al patrocinio de IESMAT, serán obsequiados con un lector de libros digitales.
PROGRAMA

International PhD Fellowship Programme ‘la Caixa - Severo Ochoa’
The Spanish National Biotechnology Centre (Centro Nacional de Biotecnología, CNB) offers three 4-year working contracts, funded by Obra Social ‘la Caixa’, to provide highly talented PhD students with a unique opportunity to start a scientific career at one of the Spanish ‘Severo Ochoa’ Centres of Excellence. Working contracts will begin between September and October 2015 and include an annual gross salary that increases progressively from €18,546 in the first year to €22,558 in the fourth year, with an annual allowance for thesis-related expenses (€1,500 in the first and second years, €1,700 in the third and fourth years), and full social insurance coverage.
Who are we?
The CNB is a multidisciplinary research centre, located on the Campus of the Universidad Autónoma de Madrid, that engages in the most relevant areas of contemporary biotechnology, with a focus on four major challenges to society: infectious diseases, inflammation & cancer, sustainability of food production, and environmental pollution. These areas are covered by complementary research approaches in:
- Macromolecular structures
- Cellular & molecular biology
- Microbial biotechnology
- Plant molecular genetics
- Immunology & oncology
- Systems & synthetic biology
Who we are looking for?
The International PhD Fellowship Programme ‘la Caixa - Severo Ochoa’ is committed to scientific excellence. Successful applicants for one of the three contracts available are expected to have outstanding academic qualifications and a strong motivation to join one of our currently active research lines in biomedical or agricultural sciences.
Who can apply?
NOTE: The following points are meant to provide a brief and orientative overview of the main eligibility criteria. Please refer to the forthcoming call or contact us for detailed information (see below).
- NATIONALITY. This call is open to applicants of all nationalities. Students with nationalities outside the European Union need to accredit legal immigration in Spain before the application deadline. If selected, non-Spanish residents must have a valid work permit before signing a work contract with the CNB.
- AGE. No specific age restrictions apply for this call.
- ACADEMIC DEGREE. Students must hold a university degree that qualifies them to initiate a PhD thesis in Spain. Specifically, they must accredit that they have applied for admission or have already been admitted to a PhD programme in a Spanish university before the application deadline; before signing a work contract with the CNB, selected candidates must have successfully completed the admission process. If they hold academic degrees obtained from a university outside of Spain, PhD students must have homologated these academic degrees or accredit that they have already initiated their homologation in Spain before signing a work contract with the CNB.
- PREVIOUS PhD FELLOWSHIPS. Applicants must not have been beneficiaries of a previous PhD fellowship funded by the ‘la Caixa’ Foundation nor have been contracted as a PhD student for more than four years (six years in the case of disabled students) by any other institution; in the case of PhD students who previously obtained a Spanish fellowship according to Royal Decree 63/2006-January 27, a 12-month limit applies.
How to apply?
Applications must be submitted to the CNB umbrella organisation, the Spanish National Research Council (Agencia Estatal Consejo Superior de Investigaciones Científicas, CSIC), according to the instructions in the call for applications that will be published before January 31, 2015; the call will be open for 20 days. An independent selection committee will evaluate the academic and scientific merits of eligible candidates. Top-ranked candidates will continue the selection process by passing an interview with the selection committee. The selection process will be terminated before the end of July 2015, and successful candidates will be contracted between September and October 2015. Please consult our web page on a regular basis for updated information on the call and selection process.
How we can assist you in your fellowship application?
To confirm that your academic qualifications fulfil the expectations of this PhD Programme of Excellence, to check whether you comply with the eligibility criteria of this call, to inform you when the call is published, and to eventually guide you through the application process, we encourage you to contact our academic officer by e-mail () as soon as possible and attach the following documents in Word document or PDF format:
- letter of intent, specifying which CNB research group(s) you wish to join, and
- curriculum vitae, including your academic degrees and grades
Juan Pablo Albar. Una vida de aventura
En honor de Juan Pablo Albar, el martes 2 de diciembre de 2014 se celebró en el CNB el siguiente acto:

Juan Pablo Albar (1953-2014), amante de grandes retos, explorador incansable, partió a su última expedición, esa que uno emprende en solitario. El escalador de cimas; el corredor de fondo; el aventurero del proteoma humano y, sin duda, el bioquímico más conocido de la Antártida, nos dejó la madrugada del pasado 19 de julio. Entre proteínas e increíbles aventuras, solo al alcance de unos pocos, se marchó sin avisar a nadie, como el susurro del viento de las nevadas cumbres que tanto amaba. En él, ciencia, deporte y aventura se fundían en su más íntima esencia, en la nobleza, superación de nuevos retos, conseguir nuevos conocimientos y, en definitiva, en hacer un poquito más grande al ser humano. Los límites entre sus tres aficiones eran tenues, su naturaleza de científico y explorador le condujo a recorrer la Antártida en el Proyecto Trineo, desde su entrada por Sudáfrica hasta su salida por bahías repletas de pingüinos. “Me alegro de haber ido”, dijo y convocó “cálidamente”, desde el mismísimo Polo Sur, a la comunidad científica para trabajar con él en uno de los más grandes retos de la Biología, el Proyecto Proteoma Humano.
 Juan Pablo Albar se licenció en Ciencias Químicas en la Universidad Complutense de Madrid, donde unos años más tarde, en 1981, obtuvo el título de Doctor. Tras unos años de trabajo en el sector privado, comenzó su trayectoria académica en el Centro Nacional de Biotecnología del Consejo Superior de Investigaciones Científicas (CNB-CSIC), donde se convirtió en uno de los pioneros y principales impulsores de la proteómica en España, punto de referencia necesario en grandes iniciativas, nacionales e internacionales, destinadas a entender la biología humana y las causas de la enfermedad. Fue Investigador Científico del CSIC, Director de la Unidad de Proteómica del CNB, coordinador de la Plataforma de Proteómica en Red del Instituto de Salud Carlos III (ProteoRed-ISCIII), coordinador de la Plataforma de Recursos Biomoleculares y Bioinformáticos, PRB2-ISCIII, miembro de las Juntas Directivas de la Sociedad Española de Proteómica (SEProt), de la Asociación de Proteómica Europea (EuPA), de la Organización del Proteoma Humano (HUPO), miembro del Comité Ejecutivo del Proyecto Proteoma Humano (HPP), Director del Proyecto Proteoma Humano Español centrado en investigar el proteoma asociado al cromosoma 16. Su trabajo ha dado lugar a más de 160 publicaciones científicas y ha servido de inspiración a numerosos investigadores en el ámbito de la proteómica y de la bioquímica en general.
Juan Pablo Albar se licenció en Ciencias Químicas en la Universidad Complutense de Madrid, donde unos años más tarde, en 1981, obtuvo el título de Doctor. Tras unos años de trabajo en el sector privado, comenzó su trayectoria académica en el Centro Nacional de Biotecnología del Consejo Superior de Investigaciones Científicas (CNB-CSIC), donde se convirtió en uno de los pioneros y principales impulsores de la proteómica en España, punto de referencia necesario en grandes iniciativas, nacionales e internacionales, destinadas a entender la biología humana y las causas de la enfermedad. Fue Investigador Científico del CSIC, Director de la Unidad de Proteómica del CNB, coordinador de la Plataforma de Proteómica en Red del Instituto de Salud Carlos III (ProteoRed-ISCIII), coordinador de la Plataforma de Recursos Biomoleculares y Bioinformáticos, PRB2-ISCIII, miembro de las Juntas Directivas de la Sociedad Española de Proteómica (SEProt), de la Asociación de Proteómica Europea (EuPA), de la Organización del Proteoma Humano (HUPO), miembro del Comité Ejecutivo del Proyecto Proteoma Humano (HPP), Director del Proyecto Proteoma Humano Español centrado en investigar el proteoma asociado al cromosoma 16. Su trabajo ha dado lugar a más de 160 publicaciones científicas y ha servido de inspiración a numerosos investigadores en el ámbito de la proteómica y de la bioquímica en general.
Gran científico, deportista y, sobre todo amigo, Juan Pablo nos dejó un legado de optimismo y saber hacer que nos guiará en el desarrollo futuro de los proyectos que él inició y que han permitido convertir a nuestro país en una referencia indiscutible dentro de una disciplina emergente, como lo es la Proteómica y sus aplicaciones en el ámbito de la salud.
Microscopía electrónica en 3D para revelar un mecanismo de plegamiento de proteínas
Una investigación llevada a cabo en el Centro Nacional de Biotecnología del CSIC (CNB) ha contribuido a determinar en términos estructurales el mecanismo por el que la proteína Hop media en el correcto plegamiento del receptor de una hormona mediante la interacción de forma sucesiva con las chaperonas Hsp70 y Hsp90.
Bajo la dirección del científico del CNB José María Valpuesta, los investigadores han sido capaces de superar la flexibilidad intrínseca de estas proteínas y determinas las estructuras, usando técnicas de microscopía electrónica diversas, los diferentes complejos entre las chaperonas Hsp70 y Hsp90 con el sustrato, el receptor de glucocorticoides.
Como se muestra en este estudio publicado en la revista Nature Communications Como se muestra en este estudio publicado en la revista Nature Communications, el plegamiento, el ensamblaje y la maduración de receptor de glucocorticoides empieza cuando es reconocido por la chaperona Hsp70, una proteína esencial para controlar la calidad de las proteínas de la célula.
El complejo entre Hsp70 y el receptor de glucocorticoides es a su vez reconocido por otro complejo, el formado por la co-chaperona Hop y el dímero de la chaperona Hsp90. Mediante el procesamiento de las imágenes obtenidas por microscopía electrónica, los investigadores han podido observar que la flexibilidad del dímero de Hsp90 se reduce tras la unión de una molécula de la proteína Hop. De este modo, se produce una reorganización de esta estructura que da lugar principalmente a dos conformaciones del complejo Hsp90:Hop, explica Valpuesta, “una estructura extendida que reconoce el complejo Hsp70:receptor de glucocorticoides e interacciona con él y otra compacta en la que Hsp70 contacta con uno de los monómeros de Hsp90”. Precisamente, es este movimiento entre una conformación y la otra el que sirve para traspasar la molécula del receptor de glucocorticoides al dímero de Hsp90, el cual se encargará de paso final en el proceso de plegamiento.
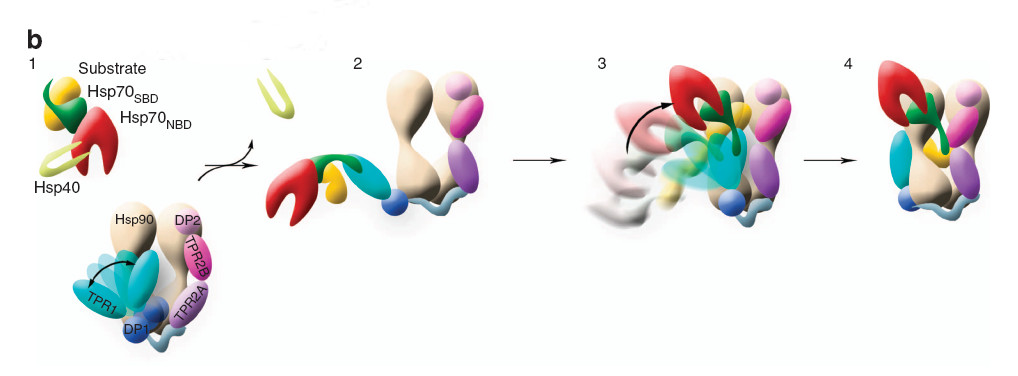
- Alvira S, Cuéllar J, Röhl A, Yamamoto S, Ito H, Alfonso CB, Rivas G, Buchner J, Valpuesta JM. Structural characterization of the substrate transfer mechanism in HSP70/Hsp90 folding machinery mediated by Hop. Nat Commun. 2014; 5: 5484.
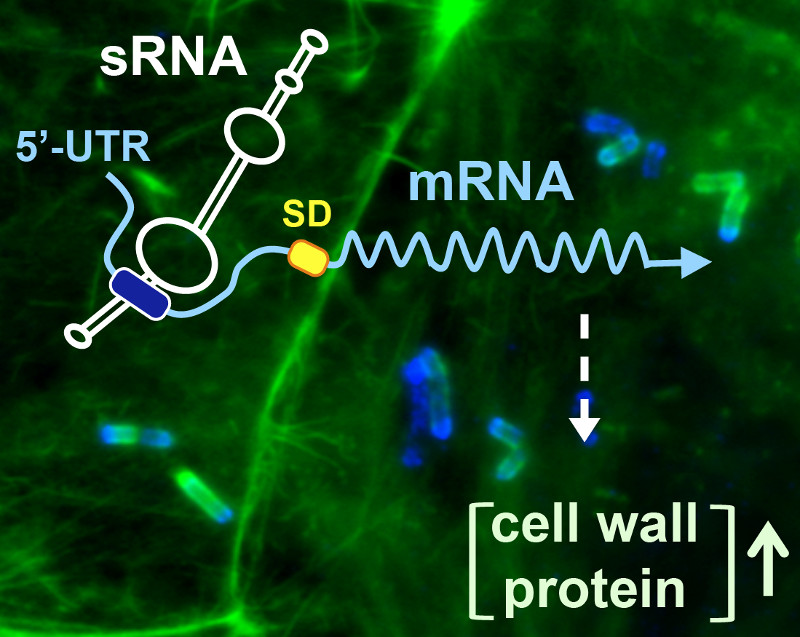
Describen cómo Listeria regula la expresión de una proteína de superficie dentro de nuestras células
Un grupo de investigadores del Centro Nacional de Biotecnología del CSIC (CNB) ha descubierto un mecanismo por el que la bacteria patógena Listeria monocytogenes aumenta la expresión de una proteína de su pared cuando crece dentro de células eucariotas.
 Con una mortalidad estimada de un 20–30%, las infecciones por L. monocytogenes progresan rápidamente debido a que el patógeno es capaz de cruzar nuestras barreras de defensa (epitelio intestinal, placenta, barrera hematoencefálica). A continuación, la bacteria invade las células del hospedador y prolifera dentro de ellas. Las bases moleculares que sustentan la capacidad de L. monocytogenes para adaptarse y vivir dentro de células eucariotas son en gran medida desconocidas. No obstante, datos recientes obtenidos por técnicas de proteómica y transcriptómica muestran una expresión selectiva de determinados genes y proteínas cuando el patógeno crece en el interior de la célula hospedadora.
Con una mortalidad estimada de un 20–30%, las infecciones por L. monocytogenes progresan rápidamente debido a que el patógeno es capaz de cruzar nuestras barreras de defensa (epitelio intestinal, placenta, barrera hematoencefálica). A continuación, la bacteria invade las células del hospedador y prolifera dentro de ellas. Las bases moleculares que sustentan la capacidad de L. monocytogenes para adaptarse y vivir dentro de células eucariotas son en gran medida desconocidas. No obstante, datos recientes obtenidos por técnicas de proteómica y transcriptómica muestran una expresión selectiva de determinados genes y proteínas cuando el patógeno crece en el interior de la célula hospedadora.
Dirigidos por el microbiólogo del CNB Francisco García-del Portillo, un grupo de científicos acaba de publicar en la revista PLOS Genetics un mecanismo de regulación de una proteína anclada a la pared bacteriana de L. monocytogenes por parte de un “ARN pequeño”. Este proceso culmina con la producción preferencial de la proteína sólo cuando el patógeno crece en la célula eucariota. En colaboración con la investigadora de la Universidad Autónoma de Madrid, Graciela Pucciarelli, han descubierto que “esta especificidad se consigue porque las bacterias intracelulares transcriben una variante del ARN mensajero que contiene una región no traducida (UTR) en el extremo 5’ inusualmente larga (234 nucleótidos) a la que podría unirse el ARN regulador”.
Esta regulación “espacial” consigue que la producción de esta proteína esté fuertemente apagada cuando la bacteria crece en medios de laboratorio. La situación se invierte en bacteria intracelular, cuando se produce de forma mayoritaria una variante del ARN mensajero reconocida por el ARN regulador.
Reforzando este mecanismo, los autores describen que la bacteria intracelular aumenta la cantidad del ARN pequeño Rli27 durante el ciclo infectivo. Según explica García-del Portillo, el aumento de ambos elementos en respuesta a la infección, tanto del ARN regulador (Rli27) como de la variante del ARN mensajero del gen diana que expone un sitio de unión para ese ARN, asegura que “esta proteína de superficie del patógeno se produzca de forma selectiva dentro de la célula hospedadora” en lugar del ambiente extracelular.
- Quereda JJ, Ortega ÁD, Pucciarelli MG, García-del Portillo F. The Listeria small RNA Rli27 regulates a cell wall protein inside eukaryotic cells by targeting a long 5′-UTR variant. PLoS Genet. 10 (10): e1004765.
XXII Workshop Avances en Biología Molecular por Jóvenes Investigadores en el Extranjero
El Centro Nacional de Biotecnología del CSIC celebrará en Madrid el lunes 22 de diciembre de 2014 la vigesimosegunda edición de su tradicional jornada Avances en Biología Molecular por Jóvenes Investigadores en el Extranjero. En ella participan, año tras años científicos postdoctorales españoles que trabajan fuera de nuestras fronteras y que vuelven a casa por Navidad.
La asistencia es libre y las jornadas finalizarán con una mesa redonda en la que se comentarán las distintas posibilidades de financiación dentro del sistema científico español.
PROGRAMA

Descubren una proteína que actúa como sensor de fosfato
Un grupo de científicos del Centro Nacional de Biotecnología del CSIC (CNB) ha descubierto una proteína que actúa como un sensor de fosfato en plantas. Según explica Javier Paz-Ares, director de este estudio, habrá que tener en cuenta esta proteína para a la hora de desarrollar una agricultura más sostenible.
 El fósforo es un nutriente fundamental para todos los organismos. Las plantas lo toman del suelo en forma de fosfato, pero al ser muy insoluble, comenta Paz-Ares, en la mayoría de los suelos se encuentra en bajas concentraciones comprometiéndose el rendimiento de las cosechas. La identificación de esta proteína, capaz de percibir la disponibilidad de fosfato en plantas y promover la adaptación del crecimiento, desarrollo y metabolismo acorde con dicha disponibilidad, provee de una herramienta biotecnológica para mejorar la eficiencia en la utilización de fosfato por las plantas, y así reducir las necesidades de fertilizantes.
El fósforo es un nutriente fundamental para todos los organismos. Las plantas lo toman del suelo en forma de fosfato, pero al ser muy insoluble, comenta Paz-Ares, en la mayoría de los suelos se encuentra en bajas concentraciones comprometiéndose el rendimiento de las cosechas. La identificación de esta proteína, capaz de percibir la disponibilidad de fosfato en plantas y promover la adaptación del crecimiento, desarrollo y metabolismo acorde con dicha disponibilidad, provee de una herramienta biotecnológica para mejorar la eficiencia en la utilización de fosfato por las plantas, y así reducir las necesidades de fertilizantes.
En colaboración con investigadores del Instituto Max Planck de Colonia y de la Universidad de Zheijang, las investigadoras del CNB Mabel Puga e Isabel Mateos identificaron este sensor mediante la búsqueda de proteínas que interaccionaban con un activador clave de la respuesta al ayuno de fosfato en plantas. Posteriormente comprobaron que la interacción entre la proteína sensora y el activador sólo tiene lugar cuando las plantas tienen suficiente cantidad de fosfato y que conlleva la inhibición de la respuesta. Es decir, el sistema de respuesta al ayuno de fosfato, más que activarse cuando la planta sufre carencia de fosfato, se inactiva cuando la planta recibe suficiente fosfato.
Este sensor de fosfato de plantas que acaban de descubrir muestra parecido con uno descrito en levaduras, pero “es llamativo que los mecanismos de acción de los sensores de ambos organismos sean muy distintos”, recalca Paz-Ares. Mientras que en el caso de levaduras, el sensor inhibe a un represor de las respuestas al ayuno cuando el fosfato es escaso, en plantas el sensor inhibe a un activador de las respuestas al ayuno cuando hay suficiente fosfato. Como se ve, se puede conseguir un mismo efecto –que la respuesta al ayuno de fosfato se produzca sólo cuando no hay fosfato- de dos maneras opuestas. Para Paz-Ares, ahora “queda por entender el porqué de estas diferencias”. Si es que hay un porqué, más allá de que plantas y levaduras son organismos que han divergido hace muchos millones de años.
- Puga MI, Mateos I, Rajulu C, Wang Z, Franco-Zorrilla JM, de Lorenzo L, Irigoyen ML, Masiero S, Bustos R, Rodríguez JF, Leyva A, Rubio V, Sommer H, Paz-Ares J. SPX1 is a phosphate-dependent inhibitor of PHOSPHATE STARVATION RESPONSE1 in Arabidopsis. PNAS. 2014; MS# 2014-04654R.
Identifican dos proteínas implicadas en el cáncer colorrectal
Un grupo de investigadores del Centro Nacional de Biotecnología del CSIC (CNB) han sido capaces de reducir drásticamente el desarrollo de tumores y la inflamación del colon en ratones. Para ello han tenido que identificar dos proteínas que no se sabía que estaban implicadas en este tipo de enfermedades.
 El grupo dirigido por Ana Cuenda ha utilizado una serie de modelos de ratón que les ha permitido estudiar porqué los pacientes con inflamación crónica en el intestino, como los que padecen la enfermedad de Crohn, desarrollan tumores de colon en una proporción mucho más alta que la población normal.
El grupo dirigido por Ana Cuenda ha utilizado una serie de modelos de ratón que les ha permitido estudiar porqué los pacientes con inflamación crónica en el intestino, como los que padecen la enfermedad de Crohn, desarrollan tumores de colon en una proporción mucho más alta que la población normal.
Sus resultados, que se acaban de publicar en la revista Cancer Research, describen cómo en un modelo de cáncer de colon asociado a colitis, la eliminación de las proteínas quinasas p38γ y p38δ reduce drásticamente el desarrollo de tumores y la inflamación en el colon. Analizando en detalle el mecanismo detrás de este descubrimiento, han observado que estas dos proteínas regulan tanto el reclutamiento de células del sistema inmune, como neutrófilos o macrófagos, a los focos de inflamación como la producción de citoquinas.
Estos hallazgos indican que p38γ y p38δ tienen un papel pro-oncogénico asociando procesos inflamatorios con el desarrollo de tumores y, según comenta Cuenda, “son posibles dianas terapéuticas en el tratamiento contra el cáncer de colon”.
- Del Reino P, Alsina-Beauchamp D, Escós A, Cerezo-Guisado MI, Risco A, Aparicio N, Zur R, Fernandez-Estevez M, Collantes E, Montans J, Cuenda A. Pro-oncogenic role of alternative p38 mitogen-activated protein kinases p38γ and p38δ, linking inflammation and cancer in colitis-associated colon cancer. Cancer Res. 2014; doi: 10.1158/0008-5472.CAN-14-0870.
