
Publican las conclusiones para prevenir otro brote de E. coli como el de 2011 en Alemania
Tras el brote de E. coli que afectó a Alemania y posteriormente a Francia la primavera del año pasado, la Academia Europea de Microbiología reunió el pasado diciembre en París a un grupo de expertos a nivel mundial para analizar lo sucedido y proponer estrategias para evitar o al menos minimizar los efectos de otros posibles brotes. En la revista científica EMBO Molecular Medicine y coordinado por el investigador del Centro Nacional de Biotecnología del CSIC Miguel Vicente, se publica ahora un artículo que recoge las conclusiones de la reunión.
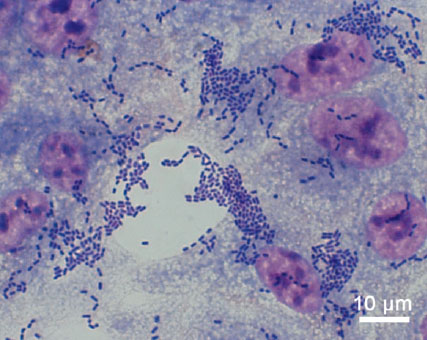 A pesar de la rapidez con la que se secuenció el genoma de la cepa de E. coli causante del brote, la mal llamada en España crisis de los pepinos se saldó con la muerte de 54 personas, en su mayoría ciudadanos alemanes, y una enormes pérdidas económicas en varios países, entre ellos España. Pese a todos los esfuerzos por identificarlo, no se tiene certeza de dónde ni cómo se originó el brote epidémico y solo existen explicaciones circunstanciales. Lamentablemente, un brote similar puede volver a darse en cualquier momento por lo que los científicos de la Academia Europea de Microbiología señalan una serie de recomendaciones para minimizar en lo posible sus efectos.
A pesar de la rapidez con la que se secuenció el genoma de la cepa de E. coli causante del brote, la mal llamada en España crisis de los pepinos se saldó con la muerte de 54 personas, en su mayoría ciudadanos alemanes, y una enormes pérdidas económicas en varios países, entre ellos España. Pese a todos los esfuerzos por identificarlo, no se tiene certeza de dónde ni cómo se originó el brote epidémico y solo existen explicaciones circunstanciales. Lamentablemente, un brote similar puede volver a darse en cualquier momento por lo que los científicos de la Academia Europea de Microbiología señalan una serie de recomendaciones para minimizar en lo posible sus efectos.
- La cepa O104:H4 muestra una sorprendente capacidad de adhesión al intestino y produce una toxina que provoca graves daños renales. Estos efectos por ahora sólo se pueden paliar eliminando la toxina mediante diálisis y manteniendo el equilibrio de electrolitos en sangre.
- Algunos antibióticos como meropenem, azitromicina o tigeciclina podrían utilizarse ya que la cepa es sensible a ellos. Otros antibióticos como la ciprofloxacina han de usarse con mucha precaución pues en dosis no inhibitorias pueden provocar un aumento en la producción de la toxina.
- Un anticuerpo comercializado como Eculizumab puede disminuir los efectos negativos de la respuesta inmunitaria que se genera en el organismo contra las toxinas de esta cepa de E. coli, pero tiene el riesgo asociado de disminuir la propia capacidad de defensa del cuerpo.
- Los expertos recomiendan que las autoridades sanitarias dispongan de procedimientos para que en este tipo de brotes el genotipado de las bacterias causantes se haga a la mayor brevedad posible. De el depende tanto el tratamiento como la eliminación de los focos de infección.
- Se hace asimismo hincapié en la necesidad de investigar a fondo los mecanismos por los que la toxina hace su efecto para así conseguir fármacos que impidan su acción en el riñón, y en la búsqueda de nuevos antibióticos que frenen la infección.
- Por último, proponen que se mejore la comunicación entre los científicos, los responsables políticos y los medios de difusión para que se afronten estos sucesos con una base científica fiable y adecuada a cada caso para minimizar los efectos sobre los ciudadanos y los sectores productivos.
Identificada una enzima clave en el inicio de la respuesta inmune
El grupo de Isabel Mérida acaba de identificar la enzima responsable del aumento del diacilglicerol en la sinapsis inmune, un paso esencial para que los linfocitos T puedan coordinar correctamente la respuesta inmunitaria.
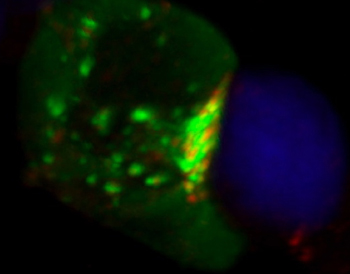 Desde su laboratorio del Centro Nacional de Biotecnología del CSIC, Mérida acaba de publicar un trabajo en el que la investigadora
postdoctoral Severine Gharbi identifica la enzima responsable del aumento de diacilglicerol en la zona de unión entre un linfocito T y un linfocito B. El aumento de este lípido en la llamada sinapsis inmune es necesario para que los linfocitos T puedan reconocer la proteína de los microorganismos contra los que dirigir su ataque.
Desde su laboratorio del Centro Nacional de Biotecnología del CSIC, Mérida acaba de publicar un trabajo en el que la investigadora
postdoctoral Severine Gharbi identifica la enzima responsable del aumento de diacilglicerol en la zona de unión entre un linfocito T y un linfocito B. El aumento de este lípido en la llamada sinapsis inmune es necesario para que los linfocitos T puedan reconocer la proteína de los microorganismos contra los que dirigir su ataque.
Además, marcando la llamada diacilglicerol kinasa ζ de tal modo que se pueda ver verde dentro del linfocito T, han observado cómo se concentra en la zona de unión al linfocito B (en azul). Una vez allí, produce el lípido necesario para que se reorganice la arquitectura de esta zona concreta de los linfocitos de cara a inicar la respuesta inmune.
- Gharbi SI, Rincón E, Ávila-Flores A, Torres-Ayuso P, Almena M, Cobos MA, Albar JP, Mérida I. Diacylglycerol kinase ζ controls diacylglycerol metabolism at the immunological synapse. Mol Biol Cell. 2011 Nov;22(22):4406-14.
p38γ y p38δ son claves en la respuesta inmunitaria
A pesar de las similitudes existentes entre las proteínas p38α, p38β, p38γ y p38δ, no están repartidas por igual en todos los tejidos y órganos y diversos compuestos químicos afectan a su actividad de manera distinta. Desde hace tiempo se sabe que las dos primeras participan en la respuesta inmune y en su laboratorio del Centro Nacional de Biotecnología del CSIC la Dra. Ana Cuenda estudia las funciones de las dos segundas, p38γ y p38δ.
 Esta misma semana su grupo ha publicado en la revista PNAS un trabajo en el que muestran que ambas proteínas desempeñan un papel fundamental en la respuesta inmune. En concreto en procesos inflamatorios como el choque séptico o la artritis reumatoide.
Esta misma semana su grupo ha publicado en la revista PNAS un trabajo en el que muestran que ambas proteínas desempeñan un papel fundamental en la respuesta inmune. En concreto en procesos inflamatorios como el choque séptico o la artritis reumatoide.
Para llegar a estas conclusiones tuvieron que generar unos ratones knockout que carecen de dichas proteínas. Con ellos, la investigadora postdoctoral Ana Risco ha comprobado que son menos sensibles al choque séptico, una respuesta inmune ante agentes infecciosos tan exagerada que acaba con la vida del ratón.
En su estudio han visto como en los macrófagos de sus ratones no se activan totalmente unas proteínas claves para la respuesta inmunitaria, ERK1 y ERK2. Por ello, se evita que se produzca choque séptico. Este resultado les hace pensar que otras enfermedades causadas por exceso de respuesta inmune tales como la artritis reumatoide pudieran también verse reducidas por la ausencia de las proteínas p38γ y p38δ.
Extrapolando estos datos a la personas, Cuenda explica que sus "resultados sugieren que terapias encaminadas a apagar la actividad de estas proteínas supondrían una mejora en los tratamientos actuales de enfermedades como la sepsis o la artritis reumatoide".
- Risco A, del Fresno C, Mambol A, Alsina-Beauchamp A, MacKenzie K, Yang H-T, Barber DF, Morcelle C, Arthur JSC, Ley SC, Ardavín C, Cuenda A. p38γ and p38δ kinases regulate TLR4-induced cytokine production by controlling ERK1/2 pathway activation. PNAS. 2012 Jun 25.
El citoesqueleto regula la expresión génica
La actina es una proteína forma el citoesqueleto de las células, participando en multitud de procesos como la elongación celular, el tráfico de proteínas a membrana o el movimiento de los orgánulos. Esta abundante proteína es prácticamente idéntica en todos los seres eucariotas, desde plantas a humanos, y suele tener funciones similares en todos los seres vivos donde se encuentra. El grupo de Antonio Leyva acaba de publicar en la revista Developmental Cell, que esta proteína es suficiente para alterar la expresión de los genes.
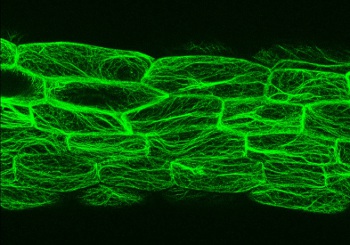 Estudiando la respuesta de las plantas a dos hormonas vegetales que regulan el crecimiento han visto que cambios en la estructura de los filamentos de actina tienen un efecto directo en la expresión de genes controlados por estas hormonas. Estos cambios son parte de procesos tan importantes como la respuesta de las plantas en la búsqueda de la luz, la capacidad de las raíces para responder a la gravedad y por tanto colonizar el suelo o la formación de raíces laterales.
Estudiando la respuesta de las plantas a dos hormonas vegetales que regulan el crecimiento han visto que cambios en la estructura de los filamentos de actina tienen un efecto directo en la expresión de genes controlados por estas hormonas. Estos cambios son parte de procesos tan importantes como la respuesta de las plantas en la búsqueda de la luz, la capacidad de las raíces para responder a la gravedad y por tanto colonizar el suelo o la formación de raíces laterales.
A pesar de que la actina se conoce desde hace más de 100 años, explica Leyva, "es una proteína prácticamente olvidada por la comunidad científica y nunca se le había atribuido un papel en la regulación transcripcional en plantas". De hecho, su trabajo es el primero que aporta evidencias genéticas de que los cambios en la configuración del citoesqueleto de actina tienen un efecto directo en la regulación de la expresión de genes mediados por hormonas regulando respuestas morfológicas vitales para las plantas.
La clave de este trabajo es un mutante del gen de la actina que mimetiza los mismos cambios en la expresión de genes que cuando se añaden las hormonas. Por ello, los investigadores concluyen que la actina no es un mero andamio en el interior celular sino que las hormonas parecen actuar mediante un efecto directo en la configuración del citoesqueleto.
- Lanza M, Garcia-Ponce B, Castrillo G, Catarecha P, Sauer M, Rodriguez-Serrano M, Páez-García A, Sánchez-Bermejo E, Tc M, Leo Del Puerto Y, Sandalio LM, Paz-Ares J, Leyva A. Role of actin cytoskeleton in brassinosteroid signaling and in its integration with the auxin response in plants. Dev Cell. 2012 Jun 12;22(6):1275-85.
Atacando a las bacterias donde más les duele
Investigadores del CSIC que participan en el proyecto de la Comisión Europea DIVINOCELL, han dado un paso más para saber cómo funciona una de las proteínas clave para que proliferen muchas bacterias, entre ellas la muy conocida Escherichia coli. Coordinado desde el Centro Nacional de Biotecnología por Miguel Vicente, el principal objetivo de este proyecto es el de encontrar nuevos antibióticos y, para ello, estudian las propiedades de FtsZ, la proteína que inicia el proceso por el que una bacteria se divide en dos.

Marisela Vélez, del Instituto de Catálisis y Petroleoquímica, también del CSIC, ha utilizado un microscopio de fuerza atómica, que permite observar con enorme detalle muestras sumergidas en una gota de líquido, para estudiar FtsZ. Sus observaciones han desvelado detalles muy importantes sobre cómo los polímeros de FtsZ, que son esenciales para la división de la bacteria, se curvan sobre una superficie de mica, llegando a formar círculos. Precisamente en la célula, FtsZ se localiza en el sitio donde se produce la división formando un anillo de mayores dimensiones que al estrecharse acaba por separar a las dos células.
Sobre la superficie de mica, los polímeros de FtsZ se estabilizan de forma transitoria, pero con el tiempo se van reduciendo de diámetro y los círculos se desvanecen. Esto ocurre porque las moléculas que componen el círculo se salen de él al azar, aunque las que se encuentran en los extremos lo hacen aún con mayor frecuencia. Según razonan los investigadores, si este proceso no existiese, los anillos difícilmente se estrecharían y la bacteria no se dividiría. El truco empleado para poder estudiar la formación y desaparición de los círculos ha sido utilizar unas condiciones bioquímicas que permiten ralentizar la separación de las moléculas de FtsZ que los componen. De este modo han podido estudiar este proceso con mayor precisión.
No cabe duda de que los compuestos que bloqueen por completo el proceso de formación o el de disgregación de los círculos de FtsZ inutilizarán el anillo de división en la bacteria impidiéndole su proliferación. Por ello, los investigadores quieren seguir colaborando con las empresas biotecnológicas que participan en el proyecto hasta encontrar un nuevo antibiótico.
En el trabajo, publicado en la revista de la Academia de Ciencias de los Estados Unidos ha requerido una notable integración de diversos conocimientos y técnicas. De hecho, en estas investigaciones han participado el grupo del Centro de Investigaciones Biológicas dirigido por Germán Rivas, científicos del Instituto de Ciencia de Materiales Nicolás Cabrera y el investigador del Departamento de Física Teórica de la Materia Condensada de la Universidad Autónoma de Madrid Pedro Tarazona.
- Mateos-Gil P, Paez A, Hörger I, Rivas G, Vicente M, Tarazona P, Vélez M. Depolymerization dynamics of individual filaments of bacterial cytoskeletal protein FtsZ. Proc Natl Acad Sci USA. 2012 May 22;109(21):8133-8.
MadrI+D premia el proyecto empresarial de Antonio Ramos
El proyecto empresarial del científico del CNB Antonio Ramos Service-Oriented Proteomics Technologies ha sido galardonado con uno de los premios MadrI+D. La ceremonia de entrega tendrá lugar hoy viernes 15 de junio a las 12:00h en el anfiteatro de la Casa de América de Madrid.
 Los premios madrI+D
se conceden a investigadores, inventores, emprendedores y autores de
blogs del sistema madrI+D, por la realización de una invención, proyecto
empresarial de base científico-tecnológica, proyecto europeo de
investigación liderado o difusión del conocimiento, atendiendo al
carácter innovador, mérito inventivo, potencial de desarrollo y
generación de ámbitos de comunicación en ciencia y tecnología.
Los premios madrI+D
se conceden a investigadores, inventores, emprendedores y autores de
blogs del sistema madrI+D, por la realización de una invención, proyecto
empresarial de base científico-tecnológica, proyecto europeo de
investigación liderado o difusión del conocimiento, atendiendo al
carácter innovador, mérito inventivo, potencial de desarrollo y
generación de ámbitos de comunicación en ciencia y tecnología.
Además de Ramos, otros cuatro científicos del CSIC han sido galardonados en esta octava edición.
Las patentes premiadas son: ‘Secuencia de nucleótidos péptidos GSE 24.2 de la disquerina inductores de la actividad telomerasa, procedimiento de obtención, composiciones terapéuticas’, cuya inventora principal es la profesora Rosario Perona de Instituto de Investigaciones Biomédicas ‘Alberto Solís’ (CSIC-UAM); y ‘Método para la identifiación de compuestos que inducen o inhiben estrés de retículo endoplásmico o estrés oxidativo’, de la doctora María Jesús Bullido del Centro de Biología Molecular Severo Ochoa (CSIC-UAM).
Por último, los premios de comunicación científica: blogs mi+d han sido otorgados a Antonio Figueras, vicepresidente del Consejo y profesor del Instituto de Investigaciones de Ciencias Marinas (CSIC), por ‘Ciencia Marina y otros asuntos’; y José Antonio López, director de cultura científica del Centro de Biología Molecular Severo Ochoa (CSIC-UAM).
Juan Luis Ramos, premio Rey Jaime I de Protección del Medio Ambiente
El jurado de los premios Rey Jaime I, formado por 22 premios Nobel, ha otorgado este año el galardón de Protección del Medio Ambiente al miembro del Comité Científico Asesor del CNB Juan Luis Ramos, por su trabajo sobre el uso de los microbios para aplicaciones medioambientales y biotecnológicas en la eliminación de contaminantes.
 Desde la Estación Experimental del Zaidín, Ramos ha contribuido en la lucha contra la contaminación medioambiental mediante el desarrollo de herramientas biológicas. Los compuestos a combatir son hidrocarburos aromáticos (benceno, tolueno, etilbenceno y xilenos), nitroaromáticos como el TNT, haloaromáticos como los PCBs y pesticidas como el lindano y el DDT. Su enfoque experimental incluye técnicas moleculares y el análisis bioquímico y genético de las rutas catabólicas, poniendo especial énfasis en las interacciones ADN/regulador, en experimentos en reactores y en la llamada rizorremediación de suelos.
Desde la Estación Experimental del Zaidín, Ramos ha contribuido en la lucha contra la contaminación medioambiental mediante el desarrollo de herramientas biológicas. Los compuestos a combatir son hidrocarburos aromáticos (benceno, tolueno, etilbenceno y xilenos), nitroaromáticos como el TNT, haloaromáticos como los PCBs y pesticidas como el lindano y el DDT. Su enfoque experimental incluye técnicas moleculares y el análisis bioquímico y genético de las rutas catabólicas, poniendo especial énfasis en las interacciones ADN/regulador, en experimentos en reactores y en la llamada rizorremediación de suelos.
Su grupo de investigación estudia también las interacciones entre plantas y microorganismos en la rizosfera con el objetivo de explotar los sistemas de expresión génica en bacterias para el desarrollo de sistemas de biocontrol, biodegradación y contención biológica de microorganismos recombinantes.
Desde el CNB queremos transmitirle nuestra más sincera enhorabuena.Un mecanismo que previene alteraciones en la formación de neuronas
Nuevo protocolo de vacunación contra la malaria
Investigadores del Centro Nacional de Biotecnología del CSIC en colaboración con la Johns Hopkins University de los EE.UU. han desarrollado un nuevo protocolo de vacunación que consigue en ratones eliminar la infección por Plasmodium, el parásito causante de la malaria.
 Gracias a una beca de la Fundación La Caixa, Aneesh Vijayan ha podido comprobar bajo la dirección del Dr. Mariano Esteban que la vacunación en dos fases consigue en ratones una protección completa frente al parásito Plasmodium yoelii. Según explica Esteban, “primero se inyecta una proteína quimérica (CS-14K) y dos semanas después se administra un virus atenuado (MVA-CS) que produce la proteína CS”.
Gracias a una beca de la Fundación La Caixa, Aneesh Vijayan ha podido comprobar bajo la dirección del Dr. Mariano Esteban que la vacunación en dos fases consigue en ratones una protección completa frente al parásito Plasmodium yoelii. Según explica Esteban, “primero se inyecta una proteína quimérica (CS-14K) y dos semanas después se administra un virus atenuado (MVA-CS) que produce la proteína CS”.
El motivo de basar la vacuna en la proteína CS se debe a un trabajo realizado en África en 2008 en el que conseguían una protección del 50% durante el primer año. Los 15.450 niños de entre 5 y 17 meses de este ensayo clínico de fase III fueron vacunados con una combinación de la proteína CS fusionada con otra proteína del virus de la hepatitis B junto con el adyuvante ASO1.
La necesidad de una vacuna que proteja en mayor grado llevó al grupo de Esteban a probar con esta nueva aproximación de la cual el CSIC ha solicitado ya una patente. Aunque se ha demostrado sólo en ratones, Esteban piensa que este trabajo supone “un paso adelante hacia el desarrollo de una vacuna con alta eficacia frente a malaria con la ventaja de que no necesita la inclusión de un adyuvante”, la cual, con una tasa de infección de unos 225 millones de personas y alrededor de 1 millón de muertes anuales, es uno de los mayores problemas de salud pública actuales.
Vijayan A, Gómez CE, Espinosa DA, Goodman AG, Sanchez-Sampedro L, Sorzano CO, Zavala F, Esteban M. Adjuvant-like effect of Vaccinia virus 14K protein: A case study with malaria vaccine based on the circumsporozoite protein. J Immunol. 2012 May 21.
Cuando menos es más
Las vacunas actuales poco tienen que ver con las primeras vacunas desarrolladas en los siglos XVIII y XIX. Aún así, la idea fundamental sigue siendo la misma: enfrentar el sistema inmune a una versión debilitada del patógeno de manera que se produzca la inmunización frente a posibles exposiciones posteriores al patógeno real. Muchas infecciones bacterianas y víricas han sido controladas eficazmente gracias al uso masivo de vacunas, pero aún existen enfermedades frente a las que no se ha conseguido desarrollar vacunas efectivas.
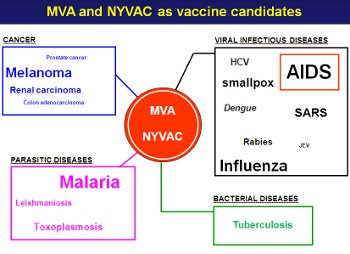 La infección por VIH es una de ellas, siendo uno de los objetivos prioritarios de numerosos grupos de investigación mundiales. El interés principal es la consecución de una inmunidad duradera en el organismo para que la respuesta inmune generada sea de larga duración. El laboratorio del Dr. Mariano Esteban en el CNB es uno de los implicados en esta búsqueda. Su estrategia opta por la utilización de variantes atenuadas del virus Vaccinia, un poxvirus perteneciente a la familia del virus de la viruela que incorpora algunos genes de VIH para producir la esperada respuesta frente a ellos. En su última publicación en la revista Journal of Virology, revelan un nuevo paso hacia este objetivo.
La infección por VIH es una de ellas, siendo uno de los objetivos prioritarios de numerosos grupos de investigación mundiales. El interés principal es la consecución de una inmunidad duradera en el organismo para que la respuesta inmune generada sea de larga duración. El laboratorio del Dr. Mariano Esteban en el CNB es uno de los implicados en esta búsqueda. Su estrategia opta por la utilización de variantes atenuadas del virus Vaccinia, un poxvirus perteneciente a la familia del virus de la viruela que incorpora algunos genes de VIH para producir la esperada respuesta frente a ellos. En su última publicación en la revista Journal of Virology, revelan un nuevo paso hacia este objetivo.
El virus NYVAC-C que expresa antígenos específicos de VIH, se basa en un virus Vaccinia atenuado mediante manipulación genética que ya carece de los genes implicados en la virulencia y patogénesis. Aún así, expresa proteínas capaces de contrarrestar la respuesta inmune del hospedador. En una aproximación dirigida a eliminar este efecto, B8R y B19R, dos de los genes responsables de esta acción, han sido eliminados en los virus utilizados en este nuevo trabajo. Su eficacia como vectores de vacunación se ha determinado mediante experimentos in vivo en ratones que muestra la existencia de una prometedora mejora en la respuesta inmune adaptativa y de memoria frente a VIH en los ratones inoculados con los virus NYVAC-C modificados.

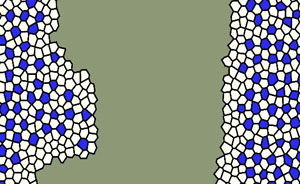 Gracias a un modelo teórico-computacional de la retina, los científicos han comprobado que la inhibición lateral, un proceso que regula la generación de neuronas en el sistema nervioso central, sufre alteraciones en los frentes neurogénicos. Estos marcan la frontera entre las regiones que están generando neuronas y las zonas vecinas, en las que aún no ha comenzado la neurogénesis.
Gracias a un modelo teórico-computacional de la retina, los científicos han comprobado que la inhibición lateral, un proceso que regula la generación de neuronas en el sistema nervioso central, sufre alteraciones en los frentes neurogénicos. Estos marcan la frontera entre las regiones que están generando neuronas y las zonas vecinas, en las que aún no ha comenzado la neurogénesis.