
En busca de una vacuna universal contra la gripe
El último trabajo del grupo de Mariano Esteban indica que una proteína quimérica podría ayudar a sentar las bases para generar una vacuna universal que proteja contra distintas estirpes del virus de la gripe.
Debido a la alta tasa de mutación que presenta el virus de la gripe, cada año se tienen que generar nuevas vacunas que intentan neutralizar la estirpe de virus que los científicos calculan que va a ser la más habitual.
 Para comprobar si pudiera ser posible la generación de una vacuna universal contra la gripe que ayude a protegerse de forma más duradera, el grupo de Poxvirus y Vacunas que dirige Mariano Esteban en el Centro Nacional de Biotecnología del CSIC ha creado una proteína quimérica que incluye partes de otras proteínas de este virus. Estas partes son fundamentales para la respuesta inmune contra la infección por el virus de la gripe, siendo la idea que funcione contra cualquier estirpe de virus.
Para comprobar si pudiera ser posible la generación de una vacuna universal contra la gripe que ayude a protegerse de forma más duradera, el grupo de Poxvirus y Vacunas que dirige Mariano Esteban en el Centro Nacional de Biotecnología del CSIC ha creado una proteína quimérica que incluye partes de otras proteínas de este virus. Estas partes son fundamentales para la respuesta inmune contra la infección por el virus de la gripe, siendo la idea que funcione contra cualquier estirpe de virus.
Mediante síntesis e ingeniería genética, la proteína quimérica ha sido incluida dentro de la nucleoproteína NP del virus de la gripe y dos de las proteínas que suelen activar la respuesta inmunitaria contra esta familia de virus (la hemaglutinina y la neuraminidasa) han sido fusionadas en una sola. Las proteínas de gripe son producidas en las células mediante la combinación de dos vectores, uno de ADN y otro el virus vaccinia que se administran en animales de forma secuencial.
Para esta prueba de concepto, se ensayó en ratones cómo de efectiva era ante una infección de gripe con virus distintos. "Aunque no hay reducción en la mortandad -señala Esteban- si que se observa una reducción en la viremia". Además, como se retrasa la mortandad de los ratones, se puede pensar que estos trabajos van en la buena dirección hacia la creación de una vacuna universal que induzca respuestas inmunes suficientes para disminuir la infección y mantener una mayor resistencia del organismo frente a virus gripales.
- Escúchalo en el programa de Radio 5 Entre probetas
La vacuna española MVA-B contra el VIH logra una respuesta inmune del 90%
Un ensayo clínico en fase I revela la eficacia inmunitaria del candidato español MVA-B a vacuna preventiva contra el virus de la inmunodeficiencia humana.
El 90% de los voluntarios sometidos al compuesto, elaborado y patentado por el CSIC, ha desarrollado una respuesta inmune al virus y el 85% de ellos la ha mantenido durante, al menos, un año. Su seguridad y eficacia son descritas en sendos artículos en las revistas Vaccine y Journal of Virology.
 En 2008, la MVA-B demostró una alta eficacia en ratones y macacos, y protección contra el virus de la inmunodeficiencia del simio (SIV). Este hallazgo ha motivado la ejecución del ensayo clínico en 30 voluntarios sanos, dirigido por el Hospital Clínic de Barcelona y con el Gregorio Marañón de Madrid. Gracias a su alta respuesta inmunológica en humanos, el equipo iniciará con la Red de Investigación del Sida un ensayo clínico en fase I con voluntarios infectados con VIH para comprobar su eficacia como vacuna terapéutica.
En 2008, la MVA-B demostró una alta eficacia en ratones y macacos, y protección contra el virus de la inmunodeficiencia del simio (SIV). Este hallazgo ha motivado la ejecución del ensayo clínico en 30 voluntarios sanos, dirigido por el Hospital Clínic de Barcelona y con el Gregorio Marañón de Madrid. Gracias a su alta respuesta inmunológica en humanos, el equipo iniciará con la Red de Investigación del Sida un ensayo clínico en fase I con voluntarios infectados con VIH para comprobar su eficacia como vacuna terapéutica.
El éxito del tratamiento se basa en que el sistema inmunológico puede quedar entrenado para responder frente a partículas del virus y células infectadas de forma duradera. El investigador en el Centro Nacional de Biotecnología del CSIC Mariano Esteban, responsable del desarrollo del compuesto, explica: “MVA-B ha demostrado que es tan potente o mejor que las vacunas actualmente en estudio”.
En lo relativo a la seguridad de MVA-B, “los efectos secundarios que se han producido son los que cabe esperar en cualquier tipo de vacunación, principalmente de tipo local en la zona de inyección”, asegura el responsable del equipo del Hospital Gregorio Marañón, el doctor Juan Carlos López Bernaldo de Quirós. Y añade: “No ha existido ningún efecto adverso que haya comprometido la salud de los voluntarios”.
“Los resultados deben ser tomados con cautela ya que el tratamiento sólo se ha probado en 30 voluntarios y, aunque estimula una respuesta potente en la mayoría de los casos, es pronto para predecir si las defensas inducidas prevendrán la infección”, matiza el doctor responsable del equipo de investigación del Clínic, Felipe García.
Nueva estrategia inmunitaria contra el cáncer
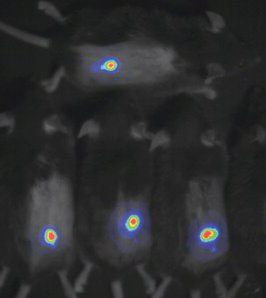 En un intento por comprender los mecanismos moleculares que controlan la respuesta inmune antitumoral, el grupo de Santos Mañes en el Centro Nacional de Biotecnología del CSIC, en colaboración con la Clínica Mayo de los Estados Unidos, ha estudiado el papel de una proteína situada en la membrana de las células. Conocida como receptor CCR5, Mañes ya comprobó en 2003 que en pacientes que habían sobrevivido al cáncer de mama eran menos frecuentes mutaciones que impedían el correcto funcionamiento de esta proteína.
En un intento por comprender los mecanismos moleculares que controlan la respuesta inmune antitumoral, el grupo de Santos Mañes en el Centro Nacional de Biotecnología del CSIC, en colaboración con la Clínica Mayo de los Estados Unidos, ha estudiado el papel de una proteína situada en la membrana de las células. Conocida como receptor CCR5, Mañes ya comprobó en 2003 que en pacientes que habían sobrevivido al cáncer de mama eran menos frecuentes mutaciones que impedían el correcto funcionamiento de esta proteína.Para poder diseñar nuevos tratamientos contra el cáncer, el grupo de Mañes, con las doctoras Emilia Mira y Alicia González-Martín, ha generado diversos modelos de cáncer en ratón en los que puede eliminar la proteína CCR5 de todas las células del organismo o específicamente de un grupo de glóbulos blancos, los linfocitos T. Mediante ensayos con químicos cancerígenos, han podido averiguar que los linfocitos que expresan CCR5 producen una respuesta inmune contra el cáncer que lleva, en un 70% de los casos, a la "eliminación total del cáncer en ratones". Unos resultados que ponen de manifiesto que CCR5 funciona reduciendo el crecimiento tumoral.
En la mayoría de los tumores humanos, el sistema inmune no reconoce como extrañas a las células cancerígenas. Eso sí, ya existen tratamientos que estimulan el sistema inmune y Santos Mañes ha podido observar que tienen una "eficacia máxima cuando los ratones expresan CCR5".
Los resultados obtenidos, señalan que la eficacia de algunos tratamientos contra el cáncer pueden verse afectados por variantes del gen CCR5 que afectana su función, apunta Mañes. "Ahora nuestro objetivo es concitar el interés de grupos clínicos con grandes cohotes de pacientes para validar esta hipótesis".
González-Martín, A., Gómez, L., Lustgarten, J., Mira, E., & Mañes, S. (2011). Maximal T Cell-Mediated Antitumor Responses Rely upon CCR5 Expression in Both CD4+ and CD8+ T Cells Cancer Research, 71 (16), 5455-5466 DOI: 10.1158/0008-5472.CAN-11-1687
XVI Ciclo de seminarios del CNB
Programa Internacional de Becas de Doctorado La Caixa
 La Fundación "La Caixa" es una entidad
sin ánimo de lucro que obtiene sus fondos de la tercera entidad financiera más
importante de España, la Caja de Ahorros y Pensiones de Barcelona, "la Caixa". Por su presupuesto y volumen de actividad, la Fundación "la Caixa"
La Fundación "La Caixa" es una entidad
sin ánimo de lucro que obtiene sus fondos de la tercera entidad financiera más
importante de España, la Caja de Ahorros y Pensiones de Barcelona, "la Caixa". Por su presupuesto y volumen de actividad, la Fundación "la Caixa"
figura entre las diez fundaciones más importantes del mundo.
Desde 1982, Fundación "la Caixa" mantiene diversos programas de becas para cursar estudios de postgrado en España y en el extranjero.
En 2008, Fundación "la Caixa" puso en marcha un nuevo programa internacional mediante el cual se convocan 10 becas de cuatro años para desarrollar un doctorado en Biomedicina en el Centro Nacional de Biotecnología del CSIC, el mayor centro español y uno de los centros líderes en el mundo en el área de Biotecnología, Biología Molecular y Biomedicina (de acuerdo a la evaluación llevada a cabo en 2005 por la organización EMBO).
De este modo, el CNB ofrece de nuevo en 2011 diez becas financiadas por la Fundación “La Caixa” para la realización de la Tesis Doctoral en las áreas de:
|
Las becas, con una dotación competitiva a nivel internacional, tendrán una duración de un año, renovables hasta un total de cuatro años.
Los candidatos tienen hasta el 13 de febrero de 2011 para enviar las solicitudes al correo electrónico .
| Convocatoria 2011: | Solicitud: |

Una delegación del Korean Institute for Advancement of Technology visita el CNB
El Ministro serbio de Ciencia y tecnología visita el CNB
El receptor nuclear X retinoide controla la inmunidad innata
Thierry Fischer ha colaborado con el grupo de Mercedes Ricote en el CNIC en descubrir que el receptor nuclear X retinoide regula la respuesta inmunitaria innata del organismo. Según publican en la revista PNAS, este receptor podría ser interesante en el tratamiento del choque séptico.
 Los receptores nucleares son un tipo de proteínas celulares que, cuando se unen a unas moléculas llamadas ligandos, regulan la expresión de multitud de genes. Estos ligandos, entre los que encontramos numerosas hormonas, pueden ser producidos por las propias células o bien encontrarse en los alimentos que ingerimos. Su función es la de regular los genes implicados en el desarrollo, el crecimiento y el metabolismo de los seres vivos.
Los receptores nucleares son un tipo de proteínas celulares que, cuando se unen a unas moléculas llamadas ligandos, regulan la expresión de multitud de genes. Estos ligandos, entre los que encontramos numerosas hormonas, pueden ser producidos por las propias células o bien encontrarse en los alimentos que ingerimos. Su función es la de regular los genes implicados en el desarrollo, el crecimiento y el metabolismo de los seres vivos.
El sistema inmunitario se encarga de proteger al organismo luchando contra microbios y matando las células tumorales. Algunos de los receptores nucleares están implicados en esta respuesta inmune, entre ellos el receptor X retinoide (RXR) que se une a derivados de la vitamina A. En principio, al matar a los patógenos, la respuesta inmune evita que enfermemos, pero, como explica el investigador del CNB Thierry Fischer, “una respuesta inflamatoria excesiva puede dañar e incluso matar al organismo dando lugar a un proceso conocido como choque séptico”, una de las principales causas de muerte entre los pacientes hospitalizados en las unidades de cuidados intensivos.
Los autores de este trabajo están interesados en conocer cómo funciona la inmunidad innata e inespecífica. Para ello generaron unos ratones que carecen de los receptores RXR en los macrófagos. Con ellos han descubierto el papel esencial que tienen en el control de los genes involucrados en la inmunidad innata. En la sangre de los ratones sin RXR, los investigadores encontraron menores niveles de quimioquinas, unas proteínas que provocan la migración de los glóbulos blancos a las zonas inflamadas. Además, cuando estos ratones sufrían peritonitis, el grado de inflamación y el número de leucocitos en la zona de la herida eran menores que en ratones normales.
Finalmente, observaron que sus ratones eran menos susceptibles al choque séptico, con lo que los receptores RXR podrían ser utilizados para tratar tanto el propio choque séptico, como enfermedades que cursen con una inflamación crónica. La industria farmacéutica está desarrollando actualmente ligandos de RXR para el tratamiento del cáncer y enfermedades metabólicas, por lo que no parece muy descabellado que pudieran crear medicamentos que inhibieran a estos receptores y fueran útiles para tratar el choque séptico.
Nuevos genes que regulan la formación de las dendritas en la sinapsis neuronal
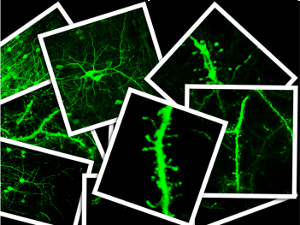 Para poder
transmitir y procesar la información, las neuronas necesitan
contactar con las otras células del cerebro. Estas conexiones tan
especializadas, conocidas como sinapsis neuronales, se producen a
través de una serie de extensiones de las ramas de las dendritas.
Como nos explica la investigadora del Centro Nacional de
Biotecnología del CSIC Marta
Nieto, la ramificación de las neuronas y la formación
adecuada y en la cantidad necesaria de las sinapsis
“es esencial a la hora de establecer los circuitos
neuronales correctos de los que dependen nuestras capacidades
intelectuales”. De hecho, frecuentemente se relacionan con
defectos cognitivos las alteraciones en las dendritas y en sus
extensiones. A pesar de su importancia, a día de hoy apenas estamos
empezando a comprender los complejos mecanismos por los que se forman
tanto las dendritas como sus sinapsis.
Para poder
transmitir y procesar la información, las neuronas necesitan
contactar con las otras células del cerebro. Estas conexiones tan
especializadas, conocidas como sinapsis neuronales, se producen a
través de una serie de extensiones de las ramas de las dendritas.
Como nos explica la investigadora del Centro Nacional de
Biotecnología del CSIC Marta
Nieto, la ramificación de las neuronas y la formación
adecuada y en la cantidad necesaria de las sinapsis
“es esencial a la hora de establecer los circuitos
neuronales correctos de los que dependen nuestras capacidades
intelectuales”. De hecho, frecuentemente se relacionan con
defectos cognitivos las alteraciones en las dendritas y en sus
extensiones. A pesar de su importancia, a día de hoy apenas estamos
empezando a comprender los complejos mecanismos por los que se forman
tanto las dendritas como sus sinapsis.
Junto con sus compañeros del grupo dirigido por Marta Nieto, Beatriz Cubelos ha descubierto en un tipo importante de neuronas situadas en la corteza cerebral de los mamíferos la participación de los genes Cux1 y Cux2 en la regulación, tanto del número de sinapsis que se forman, como de la complejidad del árbol dendrítico.
 Para llevar
a cabo sus investigaciones tuvieron que generar un ratón que carecía
del gen Cux2. De este modo, descubrieron en estos animales una
merma en la función y en el número de sus sinapsis. Todo ello
debido a las alteraciones que se producen en la estructura de sus
dendritas. La propia Marta Nieto recalca que en las
neuronas “existen una serie de factores de controlan la actividad
de las sinapsis neuronales de un modo que no habíamos imaginado
previamente”. De hecho, Cux1 y Cux2 pasan tras este
trabajo a formar parte de la lista de genes que regulan la
ramificación de las dendritas neuronales.
Para llevar
a cabo sus investigaciones tuvieron que generar un ratón que carecía
del gen Cux2. De este modo, descubrieron en estos animales una
merma en la función y en el número de sus sinapsis. Todo ello
debido a las alteraciones que se producen en la estructura de sus
dendritas. La propia Marta Nieto recalca que en las
neuronas “existen una serie de factores de controlan la actividad
de las sinapsis neuronales de un modo que no habíamos imaginado
previamente”. De hecho, Cux1 y Cux2 pasan tras este
trabajo a formar parte de la lista de genes que regulan la
ramificación de las dendritas neuronales.
Además, los genes Cux también regulan la expresión de otros genes relacionados con defectos cognitivos. Dichos genes, se sabe ahora gracias a los experimentos de los investigadores del Centro Nacional de Biotecnología del CSIC, participan en la maduración de las sinapsis entre neuronas.
El hecho de que los científicos hayan visto con anterioridad alteraciones en la morfología de las dendritas en personas con retraso mental, hace aún más interesante que los ratones del grupo de Marta Nieto presenten defectos en su memoria. De esta manera, se confirma que la modulación de la plasticidad de las sinapsis es fundamental en los procesos cognitivos, resaltando así la importancia de las neuronas de las capas superficiales de nuestro cerebro en el aprendizaje y la memoria.
Nuevo mecanismo cerebral de control del metabolismo
Los resultados publicados por Guadalupe Sabio en la revista Genes & Development muestran que la falta de la proteína JNK1 en el cerebro de ratones hace que estos coman menos, se ejerciten más y, por tanto, gasten más energía. De este modo, incluso comiendo dietas ricas en grasas, se mantienen delgados.
 Los científicos que tratan de estudiar la diabetes de tipo 2 están muy
interesados en la obesidad. Principalmente, por que las personas con
sobrepeso tienen muchas más posibilidades que las delgadas de acabar
padeciendo diabetes. Entre los modelos animales que se utilizan a la
hora de aprender sobre la diabetes, los ratones knockout
que no producen la proteína de señalización celular JNK1 son uno
de los que más información están generando sobre los mecanismos
que hacen que las dietas ricas en grasa induzcan la aparición de la
diabetes.
Los científicos que tratan de estudiar la diabetes de tipo 2 están muy
interesados en la obesidad. Principalmente, por que las personas con
sobrepeso tienen muchas más posibilidades que las delgadas de acabar
padeciendo diabetes. Entre los modelos animales que se utilizan a la
hora de aprender sobre la diabetes, los ratones knockout
que no producen la proteína de señalización celular JNK1 son uno
de los que más información están generando sobre los mecanismos
que hacen que las dietas ricas en grasa induzcan la aparición de la
diabetes.
Cuando un ratón se alimenta con comida con un elevado contenido en grasa, además de engordar, desarrolla diabetes. Sin embargo, si este ratón carece de la proteína JNK1, se mantiene delgado y no sufre diabetes. Este resultado hace preguntarse a los científicos si el ratón no es diabético debido a que no tiene JNK1, o por que no engorda. En un intento de encontrar la respuesta, la investigadora del Centro Nacional de Biotecnología del CSIC Guadalupe Sabio, en colaboración con Roger Davis del Howard Hughes Medical Institute en Massachusetts, ha generado diferentes ratones en los que esta proteína no se encuentra en diversos tejidos y órganos.
En estudios anteriores habían comprobado que cuando carecían de esta proteína en el músculo o en el tejido adiposo, los ratones, que seguían siendo obesos, tenían unos síntomas de diabetes muy moderados. Ahora han comprobado que la falta de JNK1 específicamente en el cerebro de los ratones, bloquea la ganancia de peso producida por las comidas con elevado contenido graso. Guadalupe Sabio piensa que el motivo podría estar en el mayor consumo de energía que ha detectado en estos animales y en los altos niveles en sangre de hormonas producidas por el tiroides, una glándula localizada en el cuello que controla la velocidad a la que utilizamos la energía y fabricamos las proteínas y que regula también la sensibilidad del organismo a otras hormonas.
 Los
resultados obtenidos con estos experimentos muestran la importancia
de la proteína JNK1 en el sistema nervioso a la hora de regular el
metabolismo del organismo. Su carencia, exclusivamente en el cerebro,
hace que los ratones coman menos, sean más activos y, por tanto,
tengan un mayor gasto energético. Esto provocaría que se mantengan
delgados incluso cuando ingieren una alimentación rica en grasas.
Los
resultados obtenidos con estos experimentos muestran la importancia
de la proteína JNK1 en el sistema nervioso a la hora de regular el
metabolismo del organismo. Su carencia, exclusivamente en el cerebro,
hace que los ratones coman menos, sean más activos y, por tanto,
tengan un mayor gasto energético. Esto provocaría que se mantengan
delgados incluso cuando ingieren una alimentación rica en grasas.
El verdadero motivo por el que se producen estos efectos no es del todo conocido y abre un nuevo campo de investigación en el modo en el que el cerebro regula la cantidad de comida que ingerimos. En este aspecto es interesante una de las observaciones de esta investigación: alimentados con un tipo de comida muy grasa, los ratones sin JNK1 en el cerebro tienen una mayor cantidad de receptores de una hormona encargada de regular la saciedad, la leptina. De este modo, con los mismos niveles de dicha hormona, al haber más receptores, su efecto es mayor, lo que lleva a estos animales a comer menos.








 Una delegación del Korean Institue for Advancement of Technology visita el CNB para discutir "system of Technology Commercialization, supports for spin-off companies, Technology transfer and strategic partnership with key players in BT industries"
Adjuntos:
Carta que enviaron los coreanos a JMV describiendo el propósito de su visita.
Agenda del Evento: charlas y participantes.
Una presentación que dejaron los Coreanos del proyecto en el que se encuadraba su visita HUNIC. Hunic es un proyecto para imnplementar la Transferencia de tecnología desde la universidad a la empresa actuando en dos ejes: Investigador, empresa y como eje transversal programas educativos dirigidos tanto a investigadores, estudiantes como empleados de empresas. Enfoque del proyecto es regional..
Una delegación del Korean Institue for Advancement of Technology visita el CNB para discutir "system of Technology Commercialization, supports for spin-off companies, Technology transfer and strategic partnership with key players in BT industries"
Adjuntos:
Carta que enviaron los coreanos a JMV describiendo el propósito de su visita.
Agenda del Evento: charlas y participantes.
Una presentación que dejaron los Coreanos del proyecto en el que se encuadraba su visita HUNIC. Hunic es un proyecto para imnplementar la Transferencia de tecnología desde la universidad a la empresa actuando en dos ejes: Investigador, empresa y como eje transversal programas educativos dirigidos tanto a investigadores, estudiantes como empleados de empresas. Enfoque del proyecto es regional..