
Luis Enjuanes, nuevo miembro internacional de la Academia Nacional de Ciencias de Estados Unidos

- Luis Enjuanes, director del grupo de coronavirus en el CNB-CSIC ha sido elegido nuevo miembro internacional de la Academia Nacional de Ciencias de Estados Unidos
- Enjuanes lidera en la actualidad uno de los dos proyectos del CNB-CSIC para lograr una vacuna contra el coronavirus SARS-CoV2
Luis Enjuanes ha sido elegido como nuevo miembro internacional de la Academia Nacional de Ciencias (National Academy of Sciences, NAS) de Estados Unidos. Esta elección reconoce la trayectoria y logros de su investigación científica. Enjuanes, profesor de investigación del CSIC en el Centro Nacional de Biotecnología y director del grupo de coronavirus, lleva más de 35 años trabajando en los mecanismos de replicación, transcripción, virulencia e interacción virus-huésped de los coronavirus. Desde enero de 2020, su grupo está trabajando en una vacuna frente al SARS-CoV-2, aplicando la misma técnica que ya usaron en los brotes de SARS-COV, en 2002, y MERS, en 2012.
Mariano Esteban recibe el Premio Castilla y León de Investigacion Científica y Técnica e Innovación 2020
El CNB apoya a EUSAGE para regular de forma justa el uso del CRISPR en cultivos
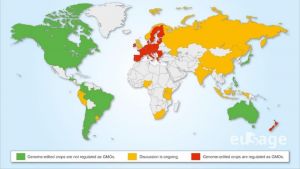
La edición genómica es una tecnología revolucionaria y cuya trascendencia ha sido reconocida con la concesión del premio Nobel a sus descubridores. Su aplicación a la mejora de cultivos trasciende al ámbito de la investigación.
La edición genómica es una nueva aproximación a la mejora genética basada en el conocimiento, que aprovecha las propias soluciones naturales de las plantas, y puede utilizarse paraa reducir los actuales requerimientos de insumos externos y haciendo posible una producción de alimentos más respetuosa con el medio ambiente.
La decisión del Tribunal de Justicia de la UE de someter las plantas mejoradas mediante edición genómica a la complicada y costosa regulación europea sobre Organismos Modificados Genéticamente (OMG) coloca a esta tecnología fuera del ámbito habitual de obtención y registro de variedades vegetales.
Esto supone un duro varapalo a las expectativas y promesas que la edición genética ofrece para la sostenibilidad y la competitividad de un sector como el agroalimentario, que tanta importancia tiene en nuestro país.
Las numerosas reacciones a esta sentencia han llevado a la UE a realizar un estudio sobre su importancia y su impacto en el seno de la Unión.
El CNB se une a las numerosas voces académicas y empresariales que reclaman una revisión de dicha legislación, de manera que no restrinja las enormes oportunidades que estas técnicas pueden aportar a la agricultura española y europea, incidiendo en la necesidad de crear unas condiciones favorables, basadas en la evidencia científica, para el desarrollo óptimo de la producción vegetal.
En este sentido, el CNB se une y apoya la carta lanzada por EUSAGE (European Sustainable Agriculture through Genome Editing), donde la comunidad científica representada por EU-SAGE señala la necesidad de que el estudio de la UE promueva un estatus regulatorio proporcionado y no discriminatorio para los cultivos mejorados mediante edición genética en la legislación europea, y que permita el desarrollo y la introducción en el mercado europeo de los cultivos con genomas editados.
Nanofestival 2021

Desde el año 2017, varios centros e institutos del CSIC ubicados en la Comunidad de Madrid participan en el Festival de Nanociencia y Nanotecnología, nacido en 2016 y coordinado a nivel internacional por la Universidad de Barcelona.
En este Festival se celebran un gran abanico de actividades dirigidas a públicos muy diversos, con el fin de acercar a la sociedad los descubrimientos en el campo de la nanociencia, así como sus aplicaciones en nanotecnología. La Delegación Institucional del CSIC en la Comunidad de Madrid y el Instituto de Micro y Nanotecnología (IMN-CNM) del CSIC, coordinan las actividades que diferentes institutos del CSIC en la Comunidad de Madrid van a organizar y cuya información podéis encontrar aquí
La estructura de un adenovirus de lagarto ilustra el papel de los virus como actores principales en la evolución de la vida
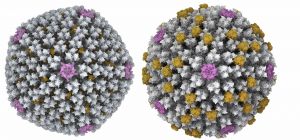
• Investigadores del CNB-CSIC y la UAM utilizan crio-microscopía electrónica para resolver la estructura a alta resolución de un adenovirus que infecta lagartos
• La combinación de los datos estructurales con análisis de secuencia muestra cómo en el pasado uno de estos virus adquirió un gen a partir de una bacteria y lo utilizó para fabricar una proteína que hace su cápsida más estable
• A lo largo de la evolución, los adenovirus pasaron a infectar mamíferos y la función del gen cambió una vez más, para convertirse en una oncoproteína capaz de alterar los ciclos de división de las células que infectan
Una investigación internacional liderada por investigadoras del Consejo Superior de Investigaciones Científicas (CSIC) y publicada en la revista Science Advances, resuelve por primera vez la estructura de un atadenovirus, un tipo de adenovirus que infecta lagartos. Las únicas estructuras de adenovirus conocidas hasta ahora pertenecían a adenovirus que infectan mamíferos, aunque existen más de 200 adenovirus que pueden infectar otras especies y que tendrían un potencial uso clínico como vectores alternativos en el desarrollo de vacunas o tratamientos para terapia génica.
Esta nueva estructura viral de alta resolución, resuelta por el grupo de Carmen San Martín en el Centro Nacional de Biotecnología (CNB-CSIC), muestra una importante diferencia en la superficie de la cápsida del atadenovirus: una proteína llamada LH3 que no existe en el adenovirus humano, pero cuya estructura de anclaje a la cápside es idéntica a la de la proteína IX del adenovirus humano, a pesar de que ambas proteínas tienen una secuencia completamente diferente. Para San Martín, “que ambos virus evolucionen para conservar una estructura concreta revela la importancia de esa estructura para la formación y mantenimiento global de la cápsida, y por tanto la supervivencia del virus”. “Además, hay otra parte de LH3 que se parece a la proteína E1B-55K de los adenovirus humanos, que no forma parte de la cápsida, sino que interfiere con el ciclo de división celular”.
Controlar el intercambio de información genética es clave para frenar la diseminación intrahospitalaria de resistencias a antibióticos

- Las poblaciones de bacterias entéricas tienen una gran capacidad de transmitir moléculas de ADN extra-cromosómico (plásmidos) con genes de resistencia a antibióticos de último recurso, utilizados en el ámbito hospitalario
- Estas resistencias se extienden en la microbiota de pacientes hospitalizados, lo que puede afectar a largo plazo a la diseminación de resistencias a nivel global, poniendo en peligro la salud pública
- Investigadores del CNB-CSIC y el IRYCIS proponen nuevos mecanismos de control específicos para frenar su expansión
El nuevo trabajo del grupo de Álvaro San Millán, investigador del Consejo Superior de Investigaciones Científicas (CSIC) en el Centro Nacional de Biotecnología (CNB-CSIC), en colaboración con el Instituto Ramón y Cajal de Investigaciones Sanitarias (IRYCIS) y la Universidad de Oxford ha realizado la caracterización epidemiológica y genética de las bacterias intrahospitalarias que transmiten nuevas resistencias frente a antibióticos.
La propagación de los mecanismos de resistencia a antibióticos de mayor relevancia clínica entre patógenos bacterianos se debe fundamentalmente al intercambio de información genética extracromosómica entre bacterias. Estas moléculas de ADN, llamadas plásmidos, se multiplican de manera autónoma y se transmiten de forma independiente del ADN cromosómico. Los resultados de esta investigación publicada en Nature Microbiology apuntan a la importancia de los plásmidos en la diseminación de mecanismos y genes de resistencia a antibióticos de nueva generación que se utilizan en entornos hospitalarios entre las enterobacterias. Estas infecciones constituyen una de las principales amenazas para los pacientes hospitalizados, especialmente en las unidades de cuidados intensivos (UCIs), donde los pacientes ancianos e inmunodeprimidos son sometidos a procedimientos invasivos, que facilitan la colonización bacteriana.
Álvaro San Millán recibe el premio Jaime Ferrán 2021

Álvaro San Millán, investigador en el departamento de Biotecnología Microbiana del CNB-CSIC ha recibido este año el premio Jaime Ferrán para investigadores jóvenes de la Sociedad Española de Microbiología (SEM).
San Millán realizó su tesis doctoral en la Universidad Complutense bajo la dirección del Dr. González-Zorn, estudiando los mecanismos de resistencia antimicrobiana de patógenos animales y humanos. Tras varios años en la universidad de Oxford trabajando en la evolución de la resistencia a antimicrobianos mediada por plásmidos, regresó a España con un contrato Miguel Servet en el Instituto Ramón y Cajal de Investigaciones Sanitarias de Madrid donde comenzó su carrera como investigador independiente. En la actualidad es científico titular en el departamento de Biotecnología Microbiana del CNB-CSIC.
Su carrera se ha desarrollado en el ámbito de las resistencias a antimicrobianos en bacterias, uno de los principales problemas para la salud pública en estos momentos, donde existe una necesidad urgente de desarrollar nuevas estrategias terapéuticas destinadas a contrarrestar las bacterias resistentes a antibióticos. Los proyectos de San Millán se centran actualmente en la función de los plásmidos en la resistencia bacteriana frente a antibióticos y en el desarrollo de nuevas estrategias de control de las enfermedades infecciosas, y se han publicado en revistas como Nature Microbiology, Science, Proceeding of the National Academy of Sciences o eLife entre otras.
Descifrado cómo las bacterias usan redes de proteínas para controlar a las células durante la infección
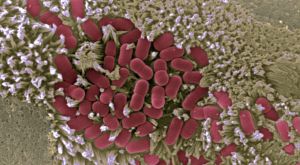
- Los resultados podrían ayudar a mejorar el diseño de vacunas y otros tratamientos frente a estos patógenos
- Los investigadores han combinado experimentos en el laboratorio con herramientas de inteligencia artificial
Un estudio en el que han participado científicos del Consejo Superior de Investigaciones Científicas (CSIC) ha logrado descifrar la forma en la que las bacterias patógenas, como Salmonella y Escherichia coli, usan redes de proteínas para controlar a las células durante una infección. Los resultados del trabajo, que han sido publicados en la revista Science, podrían ayudar a mejorar el diseño de vacunas y otros tratamientos frente a estos patógenos.
Muchas de las bacterias que producen enfermedades introducen proteínas maliciosas, denominadas efectores, en la célula, con las que reprograman sus funciones para beneficiar la infección. Los efectores toman el control de las células para, por ejemplo, evitar que se envíen señales de alarma al sistema inmune y así permitir a los intrusos colonizar el intestino.
“Los antibióticos son poco eficaces para combatir a estas infecciones ya que eliminan la flora bacteriana intestinal beneficiosa, la microbiota, y pueden acabar ayudando a las bacterias patógenas a colonizar el intestino. Por lo tanto, sigue siendo un reto encontrar tratamientos efectivos para estas infecciones y, para ello, es clave comprender cómo funciona el proceso infectivo”, explica el investigador del CSIC Luis Ángel Fernández, del Centro Nacional de Biotecnología (CNB-CSIC).
Abierto el plazo de solicitud de las Becas JAE de Introducción a la Investigación 2021 para estudiantes universitarios
Se ha publicado la nueva convocatoria para solicitar becas JAE de Introducción a la Investigación en centros del CSIC. Las 250 becas ofertadas becas están orientadas a estudiantes universitarios, especialmente aquellos en el último curso de grado universitario y tendrán una duración de 5 meses consecutivos, iniciándose en octubre de 2021.
El plazo de presentación de solicitudes a través de la web del CSIC es del 10-3-2021 al 09-04-2021
NUEVO: RESOLUCION DE CONCESIÓN: 19 julio 2021
Plazo de aceptación o renuncia: Del 21 de julio al 3 de agosto de 2021
El Centro Nacional de Biotecnología recibirá hasta 29 estudiantes en el curso 2021-2022
Rafael Giraldo, nuevo presidente electo de la Sociedad Española de Microbiología (SEM)

Rafael Giraldo, investigador del departamento de Biotecnología Microbiana en el Centro Nacional de Biotecnología (CNB-CSIC) ha sido elegido nuevo Presidente electo de la Sociedad Española de Microbiología (SEM). El resultado de las votaciones se dio a conocer el pasado viernes en la reunión de la Junta Directiva de la Sociedad. Según los Estatutos de la Sociedad, durante los dos próximos años permanecerá como Vicepresidente, continuando hasta entonces como Presidente efectivo Antonio Ventosa (U. de Sevilla).
Giraldo, que se incorporó al CNB a finales de 2018, ha desarrollado la mayoría de su carrera en el Centro de Investigaciones Biológicas (CIB) del CSIC estudiando las interacciones entre proteínas y ADN, en particular en la replicación de plásmidos, utilizando como modelos levaduras y bacterias y aproximaciones interdisciplinares. Sus trabajos más recientes estudian la formación de agregados amiloides de proteínas en E. coli, los mecanismos moleculares que determinan la transformación entre amiloides funcionales y citotóxicos, y sus aplicaciones como posibles herramientas moleculares sintéticas en la biotecnología y biomedicina. Fue elegido miembro de la Academia Europaea (sección de biología celular y del desarrollo) en el año 2010 y ha sido Vicepresidente del Comité de Ética del CSIC entre los años 2018-2020.

