
El CNB inaugura las visitas a centros del CSIC dentro del programa CICERON
CNBerAs: una nueva serie de cómics sobre el trabajo realizado por investigadoras del CNB

-
- Para conmemorar el 8 de marzo, Día Internacional de la Mujer, comenzamos en 2023 una serie de cómics sobre el trabajo y la trayectoria de científicas del CNB.
- Las investigaciones de Amelia Nieto y Carmen Castresana, primeras elegidas en la colección.
-
¡¡¡Descubre abajo las nuevas incorporaciones en el 8M de 2024!!!
Marie Curie, Rosalynd Franklin, Margarita Salas… científicas posiblemente conocidas por gran parte de la sociedad, pero, ¿sabemos si alguna de nuestras vecinas es científica? Isabel Sola o Sonia Zuñiga son ejemplos de investigadoras que pasaron a ser reconocibles en sus barrios (y fuera de ellos) debido a la pandemia de COVID-19.
Más del 50% del personal del CNB son mujeres, sin embargo, sólo 18 de los 75 grupos de investigación del CNB, lo que corresponde a un 24%, están dirigidos o co-dirigidos por mujeres. Desde la Comisión de Igualdad del CNB-CSIC y con el objetivo de visibilizar el trabajo de investigadoras del CNB, nace la colección “CNBerAs”, una serie de cómics que desgranarán de manera sencilla los logros de científicas que han desarrollado gran parte de su trayectoria en el centro. Los dos cómics que abren la colección han sido diseñados y elaborados por Alicia Calvo-Villamañán, científica e ilustradora y también miembro de la comisión de Igualdad del CNB. Para el 8 de Marzo de 2024 se enriquece nuestra colección de CNBeras con la adición de nuevas científicas e ilustradoras y por tanto, la incorporación de nuevos estilos artísticos. Los cómics se encuentran disponibles para descarga en la web del CNB y se han realizado 100 copias para su distribución.
Lluís Montoliu se incorpora al Consejo Científico de la Fundación Lilly

La Fundación Lilly incorpora a Lluís Montoliu, investigador del CNB-CSIC, a su Consejo Científico, y destaca, entre otros aspectos, su gran experiencia colaborando con asociaciones de pacientes. Esta faceta aportará puntos de vista complementarios, tanto científicos como humanistas, a los temas que se debaten habitualmente en el consejo asesor de la Fundación. Con la incorporación de Montoliu son 14 las personalidades que forman parte del Consejo Científico presidido por Mariano Barbacid.
Entre los objetivos de la Fundación Lilly destaca el fomento de la ciencia, el impulso la medicina y la promoción de los valores del humanismo científico.
Descubierta una de las causas de la agresividad del cáncer de hígado: una ‘grapa molecular’ que ayuda a reparar el DNA roto
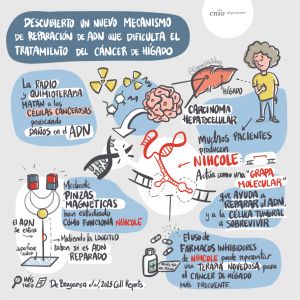
Los investigadores describen un nuevo mecanismo de reparación de DNA que dificulta el tratamiento del cáncer
- ·Han empleado ‘pinzas magnéticas’, una novedosa técnica nanotecnológica que mide cuánto se estira una única molécula de DNA. El trabajo se publica en Cell Reports.
- ·“Comprender este mecanismo podría ayudar a diseñar estrategias terapéuticas contra el cáncer de hígado más habitual”, dice Óscar Llorca, del CNIO.
Para las células son muy importantes los mecanismos de corrección de errores, porque en la rica actividad celular constantemente hay fallos de funcionamiento. Pero cuando se trata de matar células cancerosas lo que interesa es precisamente provocar errores. La radio- y la quimioterapia los provocan rompiendo el DNA de las células. Sin embargo, hay células tumorales que tienen una maquinaria de reparación del DNA excepcionalmente eficaz, y esto les permite escapar al tratamiento contra el cáncer.
Óscar Llorca, del CNIO; Fernando Moreno-Herrero, del CNB; y Puri Fortes, del CIMA-Universidad de Navarra, desvelan ahora en un trabajo en Cell Reports cómo funciona uno de estos sistemas excepcionales de reparación: una grapa molecular que una novedosa técnica nanotecnológica muestra por primera vez en acción.
Investigadores del CSIC descubren cómo los recubrimientos de las nanopartículas afectan a su biodistribución y degradación
Investigadores del IBiS y CNB demuestran que una vacuna del CSIC contra la COVID-19 protege de la infección y el daño cerebral causado por el virus
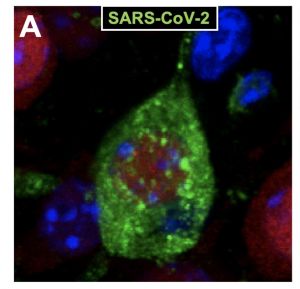
- El estudio, que se publica en la prestigiosa revista Nature Neuroscience, ha sido realizado por investigadores españoles del Instituto de Biomedicina de Sevilla (IBiS, Hospital Universitario Virgen del Rocío/CSIC/Universidad de Sevilla) y del Centro Nacional de Biotecnología (CNB-CSIC).
- Demuestran que el SARS-CoV-2 infecta y daña neuronas en distintas regiones del cerebro de un ratón susceptible al coronavirus y estos efectos son evitados completamente por la vacuna española frente a la COVID-19 desarrollada en el CNB-CSIC.
Sevilla, 9 de enero de 2023
Aunque la patología del sistema respiratorio es la principal afectación de la enfermedad COVID-19, causada por el coronavirus SARS-CoV-2, muchos de los pacientes manifiestan importantes síntomas neurológicos, como la pérdida del olfato (anosmia), dolores de cabeza, malestar general, pérdida cognitiva, epilepsia, ataxia y encefalopatía, entre otros. Sin embargo, esta afectación del sistema nervioso por parte del coronavirus no ha sido caracterizada en detalle y se desconoce si las vacunas desarrolladas frente a la COVID-19 previenen la extensión del SARS-CoV-2 al sistema nervioso central y confieren protección frente a las lesiones cerebrales.
Ahora, utilizando un modelo de ratón susceptible a la infección por el coronavirus SARS-CoV-2, un equipo multidisciplinar de investigadores españoles liderados por los Dres. Javier Villadiego y Juan José Toledo Aral (IBiS, CIBERNED y Departamento de Fisiología Médica y Biofísica de la Facultad de Medicina de Sevilla) y Juan García Arriaza (Departamento de Biología Molecular y Celular del CNB-CSIC, CIBERINFEC y PTI Salud Global del CSIC), en colaboración con otros grupos de la Universidad de Sevilla y del Consejo Superior de Investigaciones Científicas (CSIC), demuestran la capacidad del SARS-CoV-2 de infectar distintas regiones del cerebro y producir daño cerebral, y como la vacuna del CNB-CSIC protege completamente frente a dicha infección en el cerebro. Estos hallazgos se publican en la prestigiosa revista Nature Neuroscience.
Los investigadores han estudiado la evolución de la infección viral en distintas regiones cerebrales observando que la replicación del virus ocurre mayoritariamente en las neuronas, produciendo alteraciones neuropatológicas como la pérdida neuronal, activación de la glía y daño vascular. “Hemos llevado a cabo un estudio anatomo-patológico y molecular muy detallado de las regiones cerebrales y tipos de células que han sido infectadas por el virus, siendo remarcable cómo el virus infecta mayoritariamente neuronas de distintas áreas”, explica Javier Villadiego.
Una vez establecido el patrón de infección en el cerebro por parte del SARS-CoV-2, los investigadores evaluaron la eficacia de la vacuna frente a la COVID-19 desarrollada por el CNB-CSIC. Para ello, inmunizaron ratones con una o dos dosis de la vacuna MVA-CoV2-S, basada en el virus vaccinia modificado de Ankara (MVA) expresando la proteína de la espícula (S) del SARS-CoV-2, y analizaron la capacidad de protección frente a la infección y el daño en el cerebro. “Los resultados obtenidos fueron espectaculares, demostrándose que incluso la administración de una sola dosis de la vacuna MVA-CoV2-S evita completamente la infección del SARS-CoV-2 en todas las regiones cerebrales estudiadas y previene el daño cerebral asociado, incluso después de una reinfección con el virus, lo que manifiesta la gran eficacia y potencia inmunogénica de la vacuna que induce una inmunidad esterilizante en el cerebro”, como indica Juan García Arriaza.
Estos resultados refuerzan los datos previos de inmunogenicidad y eficacia de la vacuna MVA-CoV2-S en varios modelos animales. “Habíamos demostrado previamente en una serie de publicaciones que la vacuna MVA-CoV2-S que desarrollamos en el CNB-CSIC induce en tres modelos animales (ratón, hámster y macaco) una potente respuesta inmunológica de anticuerpos de unión a la proteína S del virus y de anticuerpos neutralizantes frente a distintas variantes de preocupación del virus, así como activación de linfocitos T, marcadores esenciales para el control de la infección”, apunta Mariano Esteban, investigador del CNB-CSIC implicado en el estudio.
Los resultados generados tienen importantes implicaciones a largo plazo para entender la infección causada por el SARS-CoV-2. “Los datos que hemos obtenido sobre la infección del SARS-CoV-2 en el cerebro son compatibles con la patología neurológica observada en pacientes con COVID-19”, resalta José López Barneo, investigador del IBiS participante en la publicación. “Nuestro trabajo es el primer estudio de una vacuna que tiene un 100% de eficacia frente al daño cerebral producido por el SARS-CoV-2 en un ratón susceptible, y los resultados obtenidos sugieren fuertemente que la vacuna podría prevenir el COVID-19 persistente observado en muchas personas infectadas con SARS-CoV-2”, destaca Juan José Toledo Aral.
“Los datos aportados en este estudio con inhibición completa de la replicación del SARS-CoV-2 en el cerebro mediada por la vacuna MVA-CoV2-S, junto con los estudios previos publicados por el grupo y colaboradores sobre la inmunogenicidad y eficacia de la vacuna frente a distintas variantes del SARS-CoV-2, avalan la realización de ensayos clínicos de fase I con dicha vacuna o prototipos similares para evaluar su seguridad e inmunogenicidad”, subrayan los autores del estudio.
Referencia científica:
Javier Villadiego, Juan García-Arriaza, Reposo Ramírez-Lorca, Roberto García-Swinburn, Daniel Cabello-Rivera, Alicia E. Rosales-Nieves, María I. Álvarez-Vergara, Fernando Cala-Fernández, Ernesto García-Roldán, Juan L. López-Ogáyar, Carmen Zamora, David Astorgano, Guillermo Albericio, Patricia Pérez, Ana M. Muñoz-Cabello, Alberto Pascual, Mariano Esteban, José López-Barneo & Juan José Toledo-Aral. Full protection from SARS-CoV-2 brain infection and damage in susceptible transgenic mice conferred by MVA-CoV2-S vaccine candidate. Nature Neuroscience (2023). DOI: 10.1038/s41593-022-01242-y
Noticia elaborada por la Unidad de comunicación y UCC+i del Instituto de Biomedicina de Sevilla - IBiS
Resucitan ancestros de la herramienta de edición genética CRISPR de hace 2600 millones de años
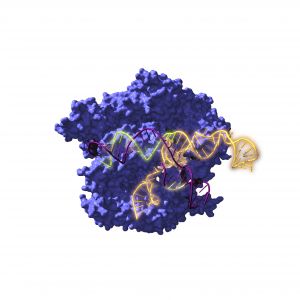
- Un estudio internacional liderado por científicos españoles descifra el origen de la herramienta de edición genética CRISPR y constata su actividad original
- El trabajo, publicado en la prestigiosa revista científica Nature Microbiology, abre nuevas vías en la manipulación de ADN y en el tratamiento de enfermedades como el cáncer o la diabetes
Un grupo de investigación internacional ha reconstruido por primera vez ancestros del conocido sistema CRISPR-Cas de hace 2.600 millones de años y ha estudiado su evolución a lo largo del tiempo. Los resultados apuntan a que los sistemas revitalizados no solo funcionan, sino que son más versátiles que las versiones actuales y podrían tener aplicaciones revolucionarias. La prestigiosa revista científica Nature Microbiology ha dado a conocer los resultados de esta investigación que, en opinión del equipo investigador “abre nuevas vías para la edición genética”.
En el proyecto, dirigido por el investigador Ikerbasque de CIC nanoGUNE Rául Pérez-Jiménez, participan equipos del Consejo Superior de Investigaciones Científicas como el de Lluís Montoliu en el Centro Nacional de Biotecnología, la Universidad de Alicante, el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER), el Hospital Ramón y Cajal-IRYCIS y otras instituciones estatales e internacionales.





