Un grupo de investigadores del Centro Nacional de Biotecnología del CSIC (CNB) han identificado un mecanismo por el que la proteína G Gβ se pliega y forma el complejo funcional que participa en la respuesta de la célula tanto a las hormonas como a los neurotransmisores.
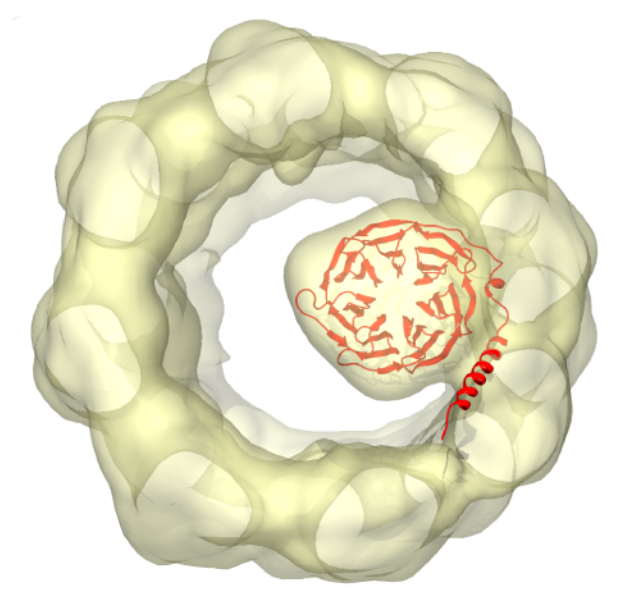 La señalización de las proteína G interviene en casi todos los aspectos de la fisiología celular, desde el desarrollo embrionario y el metabolismos hasta el aprendizaje y la memoria. Para que la señalización funcione de forma adecuada, las proteínas G α, β y γ deben ensamblarse, para lo cual necesitan la participación tanto de la chaperona CCT como de su cochaperona PhLP1. El grupo de investigación liderado por el científico del CNB José María Valpuesta, en colaboración con el laboratorio de Barry Willardson de la Bringham Young University de Utah, describe en un artículo en la revista the Proceedings of the National Academy of Sciences USA, las bases moleculares de dicho proceso. Según comenta Valpuesta, esperan que sus resultados “puedan eventualmente ser utilizados para diseñar nuevos fármacos que regulen la señalización de las proteínas G”.
La señalización de las proteína G interviene en casi todos los aspectos de la fisiología celular, desde el desarrollo embrionario y el metabolismos hasta el aprendizaje y la memoria. Para que la señalización funcione de forma adecuada, las proteínas G α, β y γ deben ensamblarse, para lo cual necesitan la participación tanto de la chaperona CCT como de su cochaperona PhLP1. El grupo de investigación liderado por el científico del CNB José María Valpuesta, en colaboración con el laboratorio de Barry Willardson de la Bringham Young University de Utah, describe en un artículo en la revista the Proceedings of the National Academy of Sciences USA, las bases moleculares de dicho proceso. Según comenta Valpuesta, esperan que sus resultados “puedan eventualmente ser utilizados para diseñar nuevos fármacos que regulen la señalización de las proteínas G”.
Gracias al uso de la criomicroscopía electrónica y del crosslinking químico, han determinado las estructuras de las proteínas durante los dos primeros pasos del ensamblaje. Primero una molécula de Gβ que todavía no está plegada correctamente, tiene que ser reconocida por la chaperona CCT. Sólo entonces la cochaperona PhLP1 interacciona con CCT provocando la separación de Gβ y liberándose el complejo PhLP1:Gβ. Ahora la molécula de Gβ puede unirse a otra de Gγ, formándose el complejo Gβγ que controla una parte importantísima de la respuesta de la célula a hormonas o neurotransmisores.
Como los investigadores comienzan a entender los mecanismos moleculares de este proceso, explica Valpuesta, empezará a ser posible “tratar alguna a los muchas enfermedades debidas a defectos en la señalización de las proteínas G”.
- Plimpton RL, Cuéllar J, Lai CW, Aoba T, Makaju A, Franklin S, Mathis AD, Prince JT, Carrascosa JL, Valpuesta JM, Willardson BM. Structures of the Gβ-CCT and PhLP1-Gβ-CCT complexes reveal a mechanism for G-protein β-subunit folding and Gβγ dimer assembly. PNAS. 2015; 112 (8): 2413-2418.
