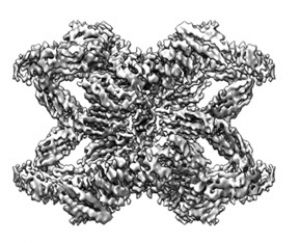
Presente en muchas funciones fisiológicas
La hA2M es una proteína muy abundante en el plasma sanguíneo humano que actúa como inhibidor de endopeptidasas (moléculas que degradan proteínas en procesos como la digestión o la señalización celular) y tiene otras funciones relevantes, como la respuesta inmune innata, la homeostasis (el equilibrio interno del organismo) y la defensa frente a patógenos. Su mal funcionamiento está relacionado con enfermedades como el Alzheimer, diabetes, progresión y crecimiento de tumores y enfermedades inflamatorias o cardiovasculares. Sin embargo, a pesar de un meticuloso análisis bioquímico durante mas de 75 años, su estructura molecular no se había caracterizado hasta ahora.
Normalmente, los inhibidores de endopeptidasas funcionan con mecanismos del tipo 'llave-y-cerradura’, receptores moleculares que reconocen y se ensamblan de forma muy específica, lo que hace que “un inhibidor solo actúe frente a una o unas pocas endopeptidasas muy concretas”. Tal y como explica Gomis-Rüth, del IBMB-CSIC, la peculiaridad de la hA2M es que “puede inhibir muchas clases de endopeptidasas de forma inespecífica”.
Castón, investigador del CNB-CSIC, destaca la peculiaridad de hA2M que “toma las proteínas que debe inactivar mediante un mecanismo de ‘trampa’, comparable al de las plantas carnívoras: cuando un insecto toca un ‘gatillo’ en el fondo de la planta abierta, se dispara un mecanismo de cierre que atrapa la presa.” De forma similar, cuando una endopeptidasa entra en la hA2M, se dispara “una reordenación ultrarrápida de su estructura de tetrámero, que da lugar a un tetrámero cerrado: una especie de jaula de la cual la endopeptidasa, como si fuera una presa, no puede escapar”.
Daniel Luque, científico del ISCIII concluye: “en este proceso también se exponen en la superficie segmentos de la molécula que están escondidos en la forma abierta, de forma que el complejo formado por hA2M y su diana puede ser reconocido por las células que se encargarán de eliminarlo de la circulación sanguínea”.
“Es así como la hA2M actúa como un cazador dentro del torrente sanguíneo en busca de peptidasas que hayan terminado sus funciones biológicas y deban eliminarse”, explican los investigadores.
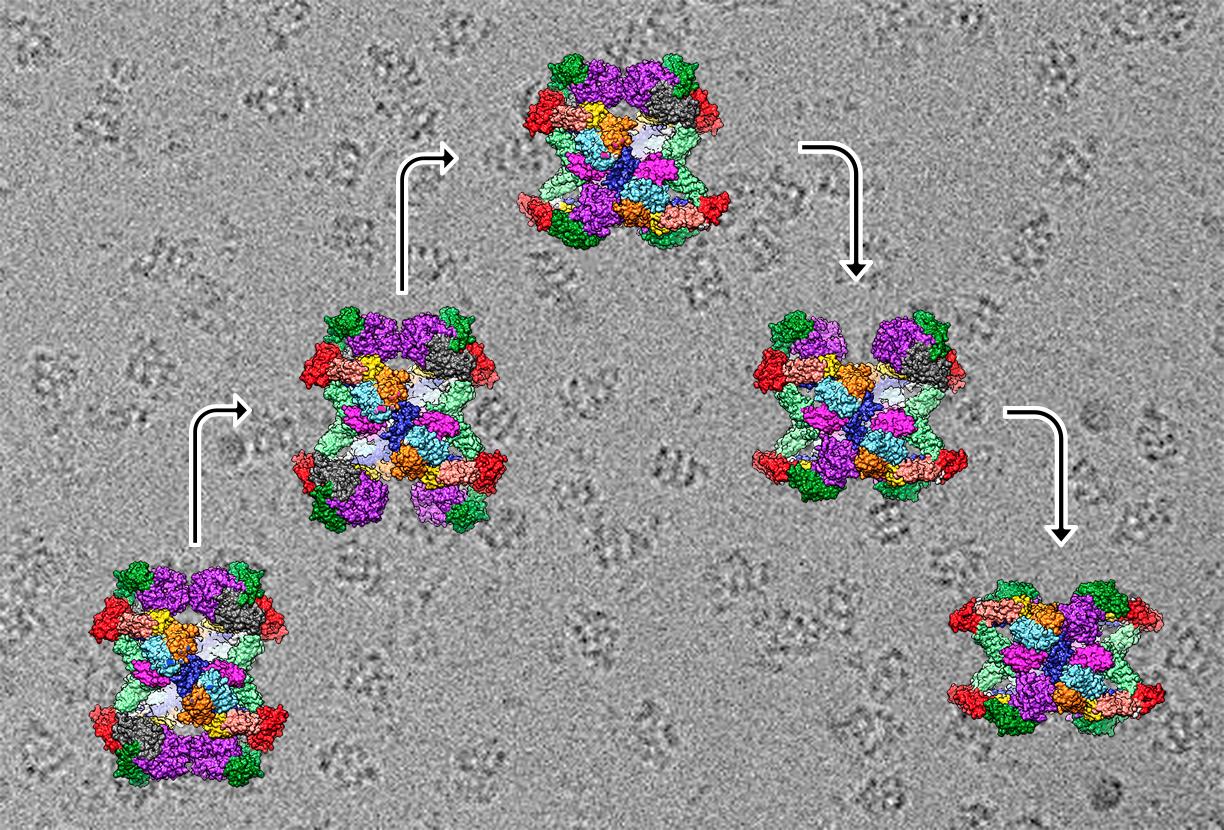
Cambios conformacionales de la molécula de alfa2-macroglobulina. JR Castón, CNB-CSIC
Referencia científica
Cryo-EM structures show the mechanistic basis of pan-peptidase inhibition by human α2-macroglobulin. Daniel Luque, Theodoros Goulas, Carlos P. Mata, Soraia R. Mendes, F. Xavier Gomis-Rüth and José R. Castón (2022). Proc. Natl. Acad. Sci., volume 119, nº 19, page e2200102119, https://doi.org/10.1073/pnas.2200102119
 https://delegacion.catalunya.csic.es/wp-content/uploads/2022/05/figura_ha2m-480x385.jpg 480w" sizes="(min-width: 0px) and (max-width: 480px) 480px, (min-width: 481px) 792px, 100vw" class="wp-image-21760" width="792" height="635">
https://delegacion.catalunya.csic.es/wp-content/uploads/2022/05/figura_ha2m-480x385.jpg 480w" sizes="(min-width: 0px) and (max-width: 480px) 480px, (min-width: 481px) 792px, 100vw" class="wp-image-21760" width="792" height="635"> https://delegacion.catalunya.csic.es/wp-content/uploads/2022/05/comp-hA2M-980x679.jpg 980w, https://delegacion.catalunya.csic.es/wp-content/uploads/2022/05/comp-hA2M-480x333.jpg 480w" sizes="(min-width: 0px) and (max-width: 480px) 480px, (min-width: 481px) and (max-width: 980px) 980px, (min-width: 981px) 1111px, 100vw" class="wp-image-21784" width="1111" height="770">
https://delegacion.catalunya.csic.es/wp-content/uploads/2022/05/comp-hA2M-980x679.jpg 980w, https://delegacion.catalunya.csic.es/wp-content/uploads/2022/05/comp-hA2M-480x333.jpg 480w" sizes="(min-width: 0px) and (max-width: 480px) 480px, (min-width: 481px) and (max-width: 980px) 980px, (min-width: 981px) 1111px, 100vw" class="wp-image-21784" width="1111" height="770">La imagen muestra la hA2M activada mediante tripsina, de la cual quedan dos unidades atrapadas en el interior. Debajo, composición que muestra el cambio de estructura de la molécula hA2M.