Lorena Carmona-Rodríguez, investigadora del CNB-CSIC, señala que “los niveles de SOD3 son altos en los tejidos sanos, pero muy bajos en la mayoría de los tumores lo que contribuye a excluir a los linfocitos citotóxicos del microambiente tumoral. “El aumento de SOD3 en el microambiente tumoral -señala Diego Martínez-Rey, co-autor del trabajo- permitiría un cambio en los vasos sanguíneos del tumor haciéndolos más permeables para la salida de las células citotóxicas”.
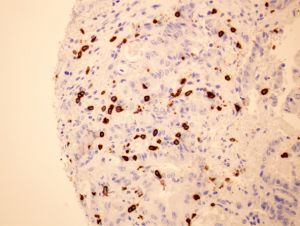
En colaboración con oncólogos y patólogos de los hospitales Clínico San Carlos y Gregorio Marañón, los investigadores han verificado que este mecanismo se produce también en tumores colorectales humanos. El tratamiento de los pacientes con cáncer de colon en estadío temprano consiste en la resección quirúrgica del tumor, aunque en algunos pacientes el tumor (recidiva) vuelve a reaparecer años más tarde. En muestras obtenidas de pacientes con cáncer los investigadores observaron una correlación positiva entre los niveles de SOD3, la infiltración de linfocitos citotóxicos y una menor tasa de recidiva de estos pacientes. El 95% de los pacientes con niveles altos de SOD3 en sus tumores no volvieron a padecer la enfermedad tras la cirugía, mientras que el 40% de los que tenían niveles bajos de SOD3 sufrieron una recidiva del tumor antes de los 5 años. Estos resultados sugieren que los niveles de SOD3 pueden ser utilizados como un biomarcador de buen pronóstico en cáncer de colon y su posible combinación con tratamientos basados en la inmunoterapia anti-tumoral.
En este trabajo, además de los científicos del CNB-CSIC, han participado oncólogos y patólogos del Hospital Universitario Clínico San Carlos y del Hospital Gregorio Marañón de Madrid, investigadores del Instituto de Investigaciones Biomédicas Alberto Sols (IIB-CSIC-UAM) y de la empresa bioinformática sevillana CAEBI.
Más información:
SOD3 induces a HIF-2α-dependent program in endothelial cells that provides a selective signal for tumor infiltration by T cells. Lorena Carmona-Rodríguez, Diego Martínez-Rey, María Jesús Fernández-Aceñero, Alicia González-Martín, Mateo Paz-Cabezas, Noe Rodríguez-Rodríguez, Beatriz Pérez-Villamil, María Eugenia Sáez, Eduardo Díaz-Rubio, Emilia Mira and Santos Mañes. Journal for ImmunoTherapy of Cancer 2020
DOI: 10.1136/jitc-2019-000432