“Los bacteriófagos son virus que infectan a bacterias. Además de su interés como modelo de estudio por su simplicidad genética pero gran complejidad estructural, ahora mismo son un nuevo foco de atención para los investigadores dado su potencial como alternativa al uso de antibióticos”, explica José L. Carrascosa, investigador del Centro Nacional de Biotecnología y codirector del trabajo.
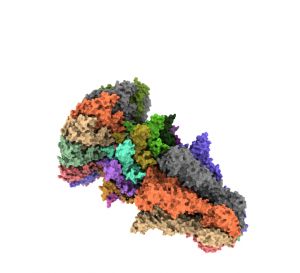
Durante el ciclo del bacteriófago T7 se forma una cápsida viral donde el virus necesita incluir su material genético, introduciéndolo a través de un pequeño canal de entrada formado por la proteína portal que posteriormente se cierra con la proteína de la cola del virus. Hasta ahora se desconocía cuál era el mecanismo que permitía abrir y cerrar esta “puerta” de entrada de manera controlada.
Ana Cuervo, también investigadora del Centro Nacional de Biotecnología y primera autora del trabajo, junto a Montserrat Fàbrega-Ferrer, del IRB Barcelona y del Instituto de Biología Molecular de Barcelona, destaca cómo “la criomicroscopía electrónica y su complementación con técnicas de cristalografía permiten no sólo resolver la estructura atómica de complejos de gran tamaño que suponen un desafío técnico, sino también definir un modelo de apertura y cierre del portal durante el proceso de translocación del ADN viral”. De esta forma, los científicos han podido identificar cuáles son las interacciones entre las diferentes proteínas que permiten los cambios en la conformación del complejo, desde una estructura abierta para permitir el paso del ADN viral a una cerrada al formar las partículas virales maduras.
Este trabajo ha contado con la financiación del programa de excelencia “Severo Ochoa” y “María de Maeztu”, el programa “Ramón y Cajal” del Ministerio de Ciencia, Innovación y Universidades, y los proyectos europeos iNEXT y Instruct-ERIC.
Referencias bibliográficas:
Ana Cuervo, Montserrat Fàbrega-Ferrer, Cristina Machón, José Javier Conesa, Francisco José Javier Fernández, Rosa Pérez-Luque, Mar Pérez-Ruiz, Joan Pous, María Cristina Vega, José L. Carrascosa y Miquel Coll. Structures of T7 bacteriophage portal and tail suggest a viral DNA retention and ejection mechanism. Nature Communications. DOI: 10.1038/s41467-019-11705-9