Un equipo internacional con participación de investigadores del Centro Nacional de Biotecnología del CSIC (CNB-CSIC) y de la Universidad Autónoma de Madrid (UAM) ha descubierto la existencia de un número considerable de miniproteínas codificadas en el genoma de la bacteria Listeria monocytogenes. El estudio, publicado en la revista Nature Microbiology, demuestra que una de estas proteínas, denominada Prli42, tendría una función clave para la recepción de señales ambientales.
El hallazgo, liderado por la investigadora Pascale Cossart, del Instituto Pasteur de París, abre una vía de estudio para estas miniproteínas y su posible aplicación biotecnológica. Además, ayuda a comprender el mecanismo por el que el macrocomplejo estresosoma se ancla a la membrana de la bacteria, proceso necesario para captar señales del ambiente y alertar a la bacteria en situaciones de estrés.
“Para adaptarse a entornos cambiantes, las bacterias han desarrollado a lo largo de su evolución numerosas funciones que activan genes de respuesta al estrés. En algunas bacterias Gram-positivas, el estresosoma, un macrocomplejo del citoplasma, transmite señales y activa funciones que alertan a la bacteria y permiten su supervivencia”, indica Francisco García-del Portillo, investigador del CSIC en el Centro Nacional de Biotecnología.
“La estructura del estresosoma se conoce bien en alguna bacteria Gram-positiva como Bacillus subtilis, pero aún no se conoce adecuadamente cómo capta las señales de estrés”, asegura María Graciela Pucciarelli, investigadora de la Universidad Autónoma de Madrid en el Centro de Biología Molecular “Severo Ochoa”.
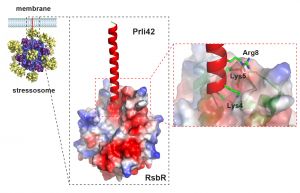
Los investigadores han realizado una nueva aproximación protéomica en la bacteria Listeria monocytogenes, un patógeno humano, que ha conducido al descubrimiento de 19 sitios de inicio de traducción interna (en regiones que codifican proteínas) y seis miniproteínas codificadas en genes que antes se asociaban exclusivamente a moléculas de RNA pequeños. Entre ellas se halla la miniproteína Prli42, que está conservada en Firmicutes (un grupo de bacterias Gram-positivas). Esta miniproteína está anclada a la membrana de la bacteria y facilita la asociación del estresosoma.
El trabajo ha supuesto un adelanto técnico y conceptual importante referido a la existencia de miniproteínas, ya sean codificadas en regiones previamente catalogadas como intergénicas o por la presencia de sitios de inicio de traducción interna dentro de regiones codificantes. La aplicación de este tipo de abordaje proteómico en otros organismos generará sin duda nuevas sorpresas, anticipándose un papel biológico importante para las miniproteínas no sospechado con anterioridad”, agrega García-del Portillo.
Por otro lado, esta investigación ha supuesto ahondar en cómo el macrocomplejo que constituye el estresosoma podría asociarse a la envoltura de la bacteria y, de esta forma, contactar con señales provenientes del ambiente que aún se desconocen.
- Fuente CSIC Comunicación
- Francis Impens, Nathalie Rolhion, Lilliana Radoshevich, Christophe Bécavin, Mélodie Duval, Jeffrey Mellin, Francisco García del Portillo, M. Graciela Pucciarelli, Allison H. Williams, Pascale Cossart. N-terminomics identifies Prli42, a membrane miniprotein critical for stressosome activation in Listeria monocytogenes. Nature Microbiology. DOI: 10.1038/nmicrobiol.2017.5